
| A. | 乙醇分子中 | B. | 乙酸和乙酸乙酯分子中 | ||
| C. | 乙醇和乙酸乙酯分子中 | D. | 乙酸分子中 |
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:解答题
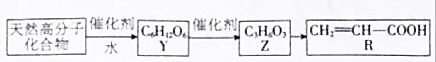
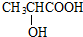
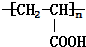
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.
工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ①②③⑤ | C. | ①②⑤⑥ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置①量取15.00mL的NaOH溶液 | |
| B. | 用装置②制备Cl2 | |
| C. | 用装置③陶瓷坩埚高温煅烧CaCO3固体 | |
| D. | 关闭活塞a,从b处加水,以检查装置④的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ②
② ③
③ ④CH3-CH═CH2-CN,其中可用于合成
④CH3-CH═CH2-CN,其中可用于合成 的高分子材料的正确组合为( )
的高分子材料的正确组合为( )| A. | ②③④ | B. | ①②③ | C. | ①③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序为M>W>X>Z>Y | |
| B. | W元素形成的可溶性盐溶液一定显碱性 | |
| C. | M、X只能形成离子化合物,且形成的离子化合物中只含离子键 | |
| D. | W的氧化物与Z、M的最高价氧化物的水化物均能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
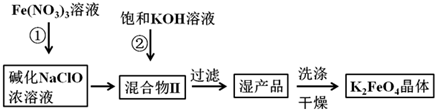
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com