
【题目】NA代表阿伏加德罗常数。已知C2H4和C4H8的混合物的质量为ag ,下列说法正确的( )
A. 燃烧时消耗的O2一定是33.6a/14 LB. 所含碳氢键数目为2aNA/7
C. 所含氢原子总数为3aNA/14D. 所含共用电子对数目为3a NA /14
【答案】D
【解析】
C2H4和C4H8的最简式为CH2,所以ag混合物中含有最简式CH2的物质的量为:![]() =
=![]() mol,ag混合物中含有
mol,ag混合物中含有![]() molC原子、
molC原子、![]() molH原子,总共含有原子的物质的量为:
molH原子,总共含有原子的物质的量为:![]() mol;
mol;
A.没有告诉在标准状况下,题中条件无法计算ag混合物物燃烧消耗氧气的准确体积,故A错误;
B.每个氢原子形成1个碳氢键,ag混合物中总共含有![]() molH原子,所以含有
molH原子,所以含有![]() molH原子碳氢键,所含碳氢键数目为
molH原子碳氢键,所含碳氢键数目为![]() NA,故B错误;
NA,故B错误;
C.由分析可知,ag混合物中含有![]() molH原子,故C错误;
molH原子,故C错误;
D无论C4H8是烯烃还是环烷烃,.在混合气体中,每个C含有1个碳碳共用电子对、每个H形成了1个碳氢共用电子对,所以总共含有![]() mol+
mol+![]() mol=
mol=![]() mol共用电子对,即
mol共用电子对,即![]() NA,故D正确;
NA,故D正确;
故答案为D。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )
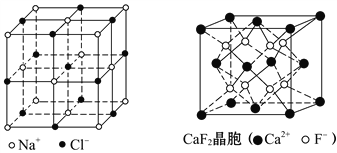
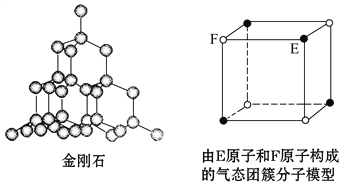
A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中所示的装置图能够达到实验目的是( )
A.  配制一定浓度的稀硫酸
配制一定浓度的稀硫酸
B.  实验室制备Fe(OH)2
实验室制备Fe(OH)2
C.  比较氯、碳、硅三种元素的非金属性强弱
比较氯、碳、硅三种元素的非金属性强弱
D.  加热熔融NaOH固体
加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氟、钙、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1) 将乙炔(C2H2)通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。1个乙炔分子中σ键数目为___________,基态Cl原子的核外电子排布式为__________,[Cu(NH3)4] 2+中Cu 2+的配位数为___________。
(2)NF3是微电子工业中优良的等离子刻蚀气体。元素第一电离能N___________F(填“>”“<”或“=”), NF3中氮原子的杂化轨道类型为____________________,NF3分子的空间构型___________。
(3)氮的氧化物中与CO2互为等电子体的分子为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为反应2H2 (g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是( )
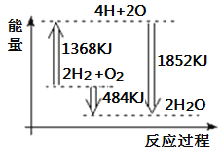
A. 由H、O原子形成2mol H2O(g),共吸收1852 kJ能量
B. 拆开2molH2 (g)和1mol O2 (g)中的化学键成为H、O原子,共放出1368kJ能量
C. 2molH2 (g)和1molO2 (g)反应生成2mol H2O(g),共放出484 kJ能量
D. 2molH2 (g)和1molO2 (g)反应生成2molH2O(l),共吸收484 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用有机物X在一定条件下可合成植物生长所需的“平衡因子”Y(部分产物未写出)。已知含有“手性碳原子”的分子可形成对映异构体。下列有关说法中正确的是( )
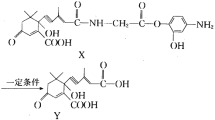
A.X,Y分子都不存在对映异构体
B.X分子中所有碳原子可能都在同一平面
C.Y分子可以发生取代、酯化、消去、加成、氧化等反应
D.未写出的产物可能有2种,且都具有两性化合物的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述中正确的是( )
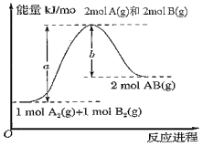
A.每生成2molAB(g)吸收的热量为(a﹣b)kJ
B.该反应是放热反应
C.1molA2(g)和1molB2(g)具有的总能量大于2molAB(g)具有的总能量
D.断裂1molA﹣A键和1molB﹣B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。
(1)①工业合成氨反应:N2+3H2![]() 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量___(填“大于”、“小于”或“等于”)920kJ。
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量___(填“大于”、“小于”或“等于”)920kJ。
②已知断开1molN![]() N键吸收的能量为945.6kJ,形成1molN﹣H键放出的能量为391kJ,根据化学方程式N2+3H2
N键吸收的能量为945.6kJ,形成1molN﹣H键放出的能量为391kJ,根据化学方程式N2+3H2![]() 2NH3,生成标准状况下44.8LNH3时放出的能量为92.4kJ,则断开1molH﹣H键吸收的能量是___。
2NH3,生成标准状况下44.8LNH3时放出的能量为92.4kJ,则断开1molH﹣H键吸收的能量是___。
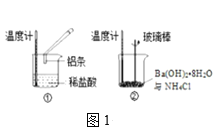
(2)某实验小组同学进行如图1所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度___(填“升高”或“降低”)。反应过程___(填“①”或“②”)的能量变化可用图2表示。
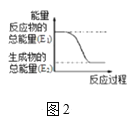
(3)已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图2所示,该反应是___(填“吸热”或“放热”)反应。
(4)用CH3OH和O2组合形成的质子交换膜燃料电池的结构如图3所示:
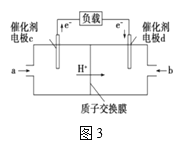
①则d电极是___(填“正极”或“负极”),c电极的电极反应式为___。
②若线路中转移2mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和钛金属的性能都很优越,在航空航天领域用途广泛。回答下列问题:
(1)钛元素基态原子的电子排布式为______________,未成对电子数为_______________个。
(2)[TiO(H2O2)2]2+配离子呈黄色。提供中心原子孤电子对的成键原子是_____________(填元素符号),中心原子的化合价为_____________;配体之一H2O2中氧原子杂化类型为__________,H2O2分子中氧原子的价层电子对互斥模型是______________。
(3)单质钒及钛都是由______________键形成的晶体,己知金属钛是六方最密堆积,金属钒是体心立方堆积,则__________(填“钛”,或“钒”)的空间利用率较大。
(4)碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图所示。
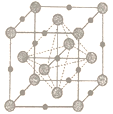 (小球为V原子)
(小球为V原子)
①晶胞中碳原子与钒原子的数量比为____________。
②该晶胞中与碳原子距离最近且相等的碳原子个数为_____________。
③若合金的密度为dg· cm-3,晶胞参数α=______nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com