
【题目】如图所示为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]

①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);
②图中压强(p1、p2、p3、p4)的大小顺序为___,理由是___。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,n(H2O)∶n(C2H4)=0.6∶1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可采取的措施有___、___。
【答案】0.072 P1<P2<P3<P4 反应分子数减少,相同温度下,压强升高乙烯转化率提高 将产物乙醇液化转移去 增加n(H2O):n(C2H4)的比
【解析】
①依据题意建立三段式,结合Kp公式计算可得;
②该反应是气体体积减小的反应,增大压强,平衡向正反应方向移动;
③若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有改变物质的浓度。
①乙烯与水反应的化学方程式为C2H4(g)+H2O(g)![]() C2H5OH(g),设C2H4、H2O的起始物质的量分别为1mol,由图可知A点乙烯转化率为20%,由此建立如下三段式:
C2H5OH(g),设C2H4、H2O的起始物质的量分别为1mol,由图可知A点乙烯转化率为20%,由此建立如下三段式:
C2H4(g)+H2O(g)![]() C2H5OH(g)
C2H5OH(g)
开始(mol) 1 1 0
转化(mol) 0.2 0.2 0.2
平衡(mol) 0.8 0.8 0.2
由三段式所得数据可知,平衡时C2H4、H2O、C2H5OH的平衡分压分别为![]() ×7.8MPa、
×7.8MPa、![]() ×7.8MPa、
×7.8MPa、![]() ×7.8Mpa,则平衡常数Kp=
×7.8Mpa,则平衡常数Kp=![]() ≈0.072,故答案为:0.072;
≈0.072,故答案为:0.072;
②由图可知,在相同的温度下由于乙烯是平衡转化率是P1<P2<P3<P4,该反应是气体体积减小的反应,增大压强,平衡向正反应方向移动,乙烯的转化率提高,则压强关系是P1<P2<P3<P4,故答案为:P1<P2<P3<P4;
③若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有改变物质的浓度,如从平衡体系中将产物乙醇分离出去,或增大水蒸气的浓度,改变二者的物质的量的比等,故答案为:将产物乙醇液化转移去,增加n(H2O):n(C2H4)的比。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>____________。基态K+电子占据最高能级的电子云轮廓图为________形。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是_______,中心原子的杂化形式为_______。NaBH4中存在_____(填标号)。
a. 离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为________,其中Be的配位数为_______。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:_____________________。
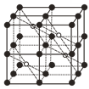
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,其空隙率是________。若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=_________ g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA 为阿伏加德罗常数)
A.124 g P4 含有 P—P 键的个数为4NA
B.1molCH4 中含有 C—H 键的个数为4NA
C.12g金刚石中含有 C—C 键的个数为4NA
D.1molCO2 晶胞中含NA 个 CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成名称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K 等。下列分析正确的是

A.题干中所列举的 6 种钾石墨属于有机高分子化合物
B.钾石墨中碳原子的杂化方式是 sp3 杂化
C.若某钾石墨的原子分布如图所示,则它所表示的是 C12K
D.最近两个 K 原子之间的距离为石墨中 C—C 键键长的2![]() 倍
倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1)
2NH3(g) ΔH=-92.4kJ·mol-1)
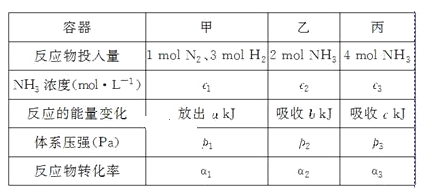
下列说法正确的是( )
A.2c1>c3B.a+b=92.4C.2p1<p3D.α1+α3>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当前,汽车尾气已成为许多城市空气的主要污染源。研究表明,含TiO2的混凝土或沥青可以部分消除汽车尾气中的氮氧化物,其原理如下:
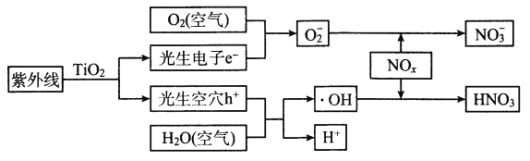
下列关于该“消除”过程的叙述不正确的是
A. 部分光能转变为化学能
B. 消除总变化为NOx+O2+H2O→HNO3
C. 消除反应能全天候发生
D. 使用纳米TiO2的消除效率更高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纸电池是一种有广泛应用的“软电池”,右图这种碱性纸电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰。下列有关该纸电池说法不合理的是

A.Zn为负极,进行氧化反应
B.电池工作时,电子由MnO2流向Zn
C.正极反应:MnO2+e-+H2O=MnO(OH)+OH-
D.电池总反应:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-。下列说法不正确的是
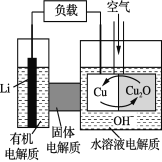
A. 放电时,Li+透过固体电解质向Cu极移动
B. 通空气时,铜被腐蚀,产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+2H+ +2 e- ===2Cu+H2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,1 L 己烷完全燃烧后,所生成的气态产物的分子数为![]() NA
NA
B.10 g 46%的乙醇溶液中氢原子的个数为 0.6 NA
C.28 g 乙烯与丙烯的混合气体,共用的电子对数为 6 NA
D.100 mL 0.1 mol/L CH3COOH 溶液跟足量乙醇、浓硫酸共热,发生酯化反应,生成乙酸乙酯分子 数为 0.01 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com