
 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行惰性电极电解饱和氯化钠溶液实验.回答下列问题:
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行惰性电极电解饱和氯化钠溶液实验.回答下列问题:分析 (1)甲烷碱性燃料电池中正极氧气得电子被还原,负极甲烷失电子被氧化;
(2)电解氯化钠溶液,实质为氯离子与水反应生成氢氧根离子、氯气和氢气;
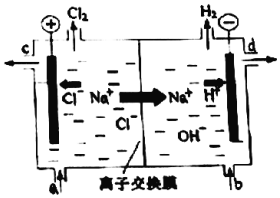
(3)电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;H2、NaOH在阴极,NaOH溶液的出口为d,Cl2在阳极,精制饱和食盐水从阳极进入;
(4)根据电子转移数目相等,分析解答.
解答 解:(1)在碱性溶液中,甲烷燃料电池的总反应式为CH4+2O2+2OH-=CO32-+3H2O,正极是:2O2+4H2O+8e-═8OH-,负极是:CH4-8e-+10OH-═CO32-+7H2O,
故答案为:2O2+4H2O+8e-=8OH-;CH4+10OH--8e-=CO32-+7H2O;
(2)电解氯化钠溶液,实质为氯离子与水反应生成氢氧根离子、氯气和氢气,反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑;
(3)电解槽中阴极是氢离子放电生成氢气,水电离平衡正向进行氢氧根离子浓度增大,生成氢氧化钠溶液,NaOH溶液的出口为d;
Cl2在阳极,依据装置图分析可知精制饱和食盐水从阳极进入,即进口为a,
故答案为:a,d;
(4)根据电子转移数目相等,CH4~8e-~4Cl2↑,所以甲烷通入量为lL(标准状况),且反应完全,则最多能产生的氯气体积为4L,故答案为:4.
点评 本题考查了电解原理的分析,电极分析判断方法,化学方程式书写等,题目难度中等.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 干冰升华和液氯气化时,都只需克服分子间作用力 | |
| B. | 硫酸氢钠晶体溶于水,需要克服离子键和共价键 | |
| C. | 氯化氢气体溶于水时,只有离子键的断裂,没有化学键的形成 | |
| D. | 石墨转化金刚石,既有化学键的断裂,又有化学键的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | (1) | (2) |
| A | FeSO4、NO2、MnO2、NaClO、Na2O2 | H2SO3 |
| B | CH3COOH、HOOC-COOH、HClO、H2S | HF |
| C | 复分解反应、电极反应、放热反应、离子反应 | 焰色反应 |
| D | (NH4)2SO4、NH4Cl、NH4NO3、NH3•H2O | NH4HCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入溶液 | ①适量的铋酸钾溶液 | ②过量的双氧水 | ③适量KI-淀粉溶液实验 |
| 现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
| A. | KBiO3、KMnO4、H2O2、I2 | B. | KMnO4、KBiO3、I2、H2O2 | ||
| C. | I2、H2O2、KMnO4、KBiO3 | D. | H2O2、I2、KBiO3、KMnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1 L pH=1的H2SO4溶液中,SO${\;}_{4}^{2-}$数目为0.1NA | |
| B. | 将7.8 g Na2O2放入足量的CO2和水蒸气组成的气体中充分反应,转移电子总数为0.1NA | |
| C. | 9 g重氧水(H${\;}_{2}^{18}$O)含电子总数为10NA | |
| D. | 常温常压下,2.24 L正戊烷、异戊烷及新戊烷的混合物,含C-H数目为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com