
| 物质 | N2 | H2 | NH3 |
| 反应前 | 16mol | xmol | 0 |
| 5min | ymol | 28mol | 8mol |
分析 (1)根据反应物和生成物书写方程式;
(2)在反应N2+3H2?2NH3中,断裂3molH-H键、1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,该反应热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,根据氮气和焓变关系式计算放出的热量;
(3)该反应是可逆反应,反应物不能完全转化为生成物;
(4)先计算氨气平均反应速率,再根据同一可逆反应中同一条件下不同物质的反应速率之比等于其计量数之比计算氮气平均反应速率;
(5)可逆反应达到平衡状态时,同一物质的正逆反应速率相等且不等于0,反应达到最大限度.
解答 解:(1)该反应方程式为N2(g)+3H2(g)?2NH3(g),故答案为:N2(g)+3H2(g)?2NH3(g);
(2)在反应N2+3H2?2NH3中,断裂3molH-H键、1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,该反应热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,1mol氮气完全反应放出92kJ能量,则0.5mol氮气完全反应放出46kJ能量,
故答案为:放出;46;
(3)1mol氮气完全反应放出92kJ能量,则0.5mol氮气完全反应放出46kJ能量,该反应是可逆反应,反应物不能完全转化为生成物,所以放出的热量要小于46kJ,故答案为:该反应是可逆反应,反应物不能完全转化为生成物,所以放出的热量要小于46kJ;
(4)v(NH3)=$\frac{\frac{8mol}{2L}}{5min}$=0.8mol/(L.min),同一可逆反应中同一条件下不同物质的反应速率之比等于其计量数之比得v(N2)=$\frac{1}{2}$v(NH3)=$\frac{1}{2}$×0.8mol/(L.min)=0.4mol/(L.min),
故答案为:0.4;
(5)a.达到平衡状态时正反应速率和逆反应速率相等且不等于0,故正确;
b.达到平衡状态时,正反应速率和逆反应速率相等且不等于0,故错误;
c.达到平衡状态时,正逆反应速率相等,处于动态平衡状态,所以N2的转化率达到最大值,故正确;
d.N2和H2的浓度相等时该反应不一定达到平衡状态,与反应物初始浓度及转化率有关,故错误;
e.N2、H2和NH3的体积分数相等时,该反应不一定达到平衡状态,与反应物初始浓度及转化率有关,故错误;
f.达到平衡状态时,正逆反应速率相等,处于动态平衡状态,反应物的转化率达到最大值,所以反应达到最大限度,故正确;
故选bde.
点评 本题考查化学平衡计算、化学平衡状态判断等知识点,把握化学平衡状态特征、化学计算基本方法是解本题关键,注意:可逆反应达到平衡状态时正逆反应速率相等(同一物质)但不能是0,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 向氢氧化铜中滴加稀盐酸:Cu(OH)2+2H+═Cu2++2H2O | |
| D. | 锌粒与稀醋酸反应:Zn+2H+═Zn2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
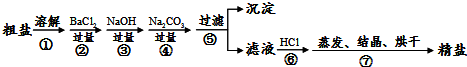
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
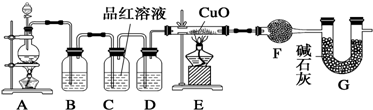
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | .①②④ | C. | ②③④ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
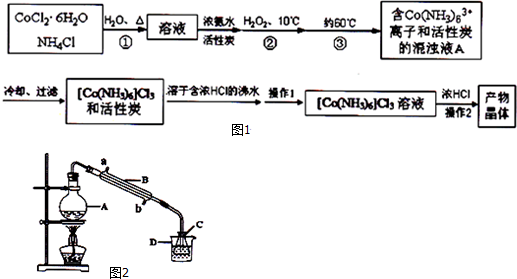
| 温度(℃) | 0 | 20 | 47 |
| 溶解度(g) | 4.26 | 6.96 | 12.74 |
| 指示剂 | 颜色 | 变色的pH范围 | ||
| 甲基红 | 红 | 橙 | 黄 | 4.4~6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | 增大压强,平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com