
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l )=2CO2 (g )+3N2 (g )+4H2O (l ) (Ⅰ)
(1)若将反应(Ⅰ)设计成原电池,则正极的电极反应式为
(酸性电解质)。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g) 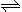 2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是________.
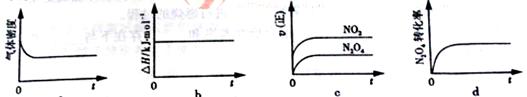
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或
“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数
Kb=2×10—5 mol·L-1)
【知识点】原电池原理、化学平衡的移动 F3 G2 H1
【答案解析】(1)N2O4+8e-+8H+=N2+4H2O ; (2)吸热 (3)a,d;不变;0.1 (4)NH4++H2O NH3.H2O+H+
NH3.H2O+H+
逆向;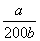
解析:(1)根据原电池得正极发生还原反应,结合酸性电解质,得到正极的电极反应式为: N2O4+8e-+8H+=N2+4H2O ;
(2)温度升高时,气体颜色变深,说明升高温度平衡向正反应方向移动,则反应(Ⅱ)为吸热反应。
(3)恒压密闭容器中,随着反应的进行气体的物质的量增大,容器体积增大,密度减小,当气体密度不变时意味着平衡不再移动,a 图正确,;b.ΔH不变不能作为平衡状态的标志;c.速率减小,c图错误;d.的转化率先增大,不变时说明反应达最大限度说明反应达到平衡状态,d正确;化学平衡常数只与温度有关,所以不变;3s后NO2的物质的量为0.6mol,则0~3s 内的平均反应速率vNO2=0.6mol/(1L·3s)=0.2mol·L-1·s-1 则0~3s内的平均反应速率v(N2O4)=0.1mol·L-1·s-1。
(4)将amol NH4NO3溶于水,溶液显酸性,原因是铵根离子水解:NH4++H2O NH3.H2O+H+
NH3.H2O+H+
原溶液是盐溶液,盐水解促进水的电离,向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将逆向移动,
根据电荷守恒式:C(NH4+)+C(H+)=C(OH-)+C(NO3-),溶液呈中性C(NH4+)=C(NO3-),结合电离平衡常数表达式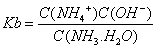 得到所滴加氨水的浓度。
得到所滴加氨水的浓度。
【思路点拨】本题考查了原电池原理、化学平衡的移动等知识,理解化学平衡状态是关键。


科目:高中化学 来源: 题型:
常温下,在0.1mol•L﹣1 CH3COOH溶液中,水的离子积是( )
|
| A. | 1×10﹣14 | B. | 1×10﹣13 | C. | 1.32×10﹣14 | D. | 1.32×10﹣15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中碘以碘酸钾(KIO3)形式存在, 已知在溶液中IO-3可和I-发生反应:IO-3+5I-+6H+=3I2+3H2O,根据此反应,可用试纸和一些生活中常见物质进行实验,证明食盐中存在IO-3,可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾 淀粉试纸,④淀粉,⑤食糖,⑥食用白醋,⑦白酒进行上述实验时必须使用的物质是 ( )
A.③⑥ B.①③
C.①②④⑤⑦ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,0.1 mol·L-1的三种盐溶液NaX、NaY、NaZ的pH分别为7、8、9,则下列判断中正确的是 ( )。
A.HX、HY、HZ的酸性依次增强
B.离子浓度:c(Z-)>c(Y-)>c(X-)
C.电离常数:K(HZ)>K(HY)
D.c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ)
查看答案和解析>>
科目:高中化学 来源: 题型:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_________________________________
______________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH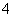 )________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
)________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH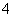 )。
)。
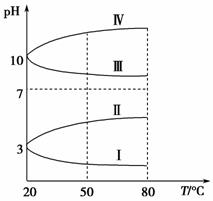
(3)如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填写序号),导致pH随温度变化的原因是________________________________;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO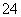 )-c(NH
)-c(NH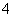 )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
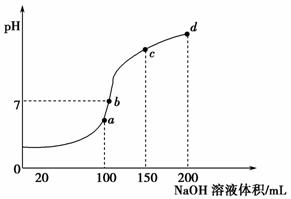
试分析图中a、b、c、d四个点,水的电离程度最大的是____________;在b点,溶液中各离子浓度由大到小的排列顺序是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 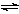 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A 该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B 因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行
C根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol·L-1)3
D达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
.反应X(g)+Y(g)  2Z(g) ΔH<0,达到平衡时,下列说法正确的是
2Z(g) ΔH<0,达到平衡时,下列说法正确的是
A.减小容器体积,平衡向右移动 B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大 D.降低温度,Y的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
.下列有关说法正确的是( )
A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.高温下,工业上用纯碱和石英砂制玻璃,说明硅酸的酸性强于碳酸
C.加热蒸干氯化铝溶液并灼烧残留物至质量不变,所得固体为氧化铝
D.高温下,用金属钠与氯化钾可以置换出金属钾,说明钠的金属性比钾强
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为( )
|
| A. | 920kJ | B. | 557kJ | C. | 436kJ | D. | 188kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com