
ГЃЮТГЃбЙЯТЃЌНЋЯТСаИїзщЦјЬхЗжБ№ГфШыЕНШнЛ§ПЩБфЕФУмБеШнЦїжаЃЌГфЗжЗДгІКѓЃЌЛжИДЕНдРДзДПіЪБЬхЛ§гЩДѓЕНаЁЕФЫГађЪЧЃКЂй2molNH3КЭ1molHClЃЌЂк2molSO2КЭ1molO2ЃЌЂл2molH2SКЭ1mol SO2ЃЌЂм2mol NOКЭ1mol O2ЃЌЂн1mol H2SКЭ1mol Cl2ЃЈ ЃЉ
AЃЎЂкЃОЂмЃОЂнЃОЂйЃОЂл BЃЎЂкЃОЂнЃОЂмЃОЂйЃОЂл
CЃЎЂмЃОЂкЃНЂнЃОЂлЃОЂйЁЁЁЁDЃЎЂмЃНЂнЃОЂкЃОЂлЃОЂй
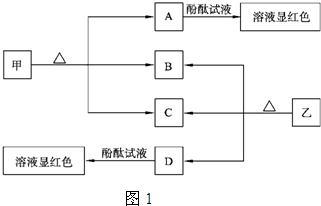
 зївЕИЈЕМЯЕСаД№АИ
зївЕИЈЕМЯЕСаД№АИ ЭЌВНбЇЕфвЛПЮЖрСЗЯЕСаД№АИ
ЭЌВНбЇЕфвЛПЮЖрСЗЯЕСаД№АИ ОЕфУмОэЯЕСаД№АИ
ОЕфУмОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ВщПДД№АИКЭНтЮі>>
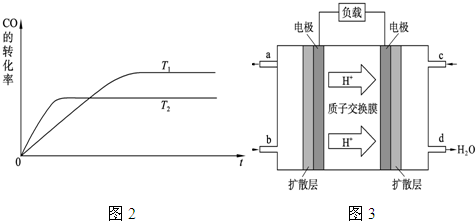
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКдФЖСРэНт
| c(CH3OH) |
| c(CO)ЁСc2(H2) |
| c(CH3OH) |
| c(CO)ЁСc2(H2) |
| b-a-4c |
| 2 |
| b-a-4c |
| 2 |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКдФЖСРэНт
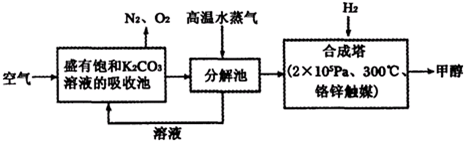
| ЮяжЪ | H2 | CO | CH3OH |
| ХЈЖШ/ЃЈmol?L-1ЃЉ | 0.2 | 0.2 | 0.4 |
ВщПДД№АИКЭНтЮі>>
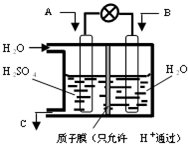
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
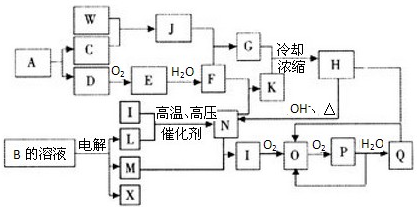
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com