
一定条件下,在密闭恒容容器中,能表示反应X(g)+2Y(g)2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④ C.②③ D.③④
科目:高中化学 来源: 题型:
硅及其化合物在自然界广泛存在并被人类应用。
(1)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。可以用NH3和SiH4(硅烷)在一定条件下反应,并在600 T的加热基板上生成氮化硅膜:
3SiH4+4NH3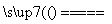 Si3N4+12H2
Si3N4+12H2
以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si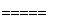 4NH3↑+SiH4↑+2MgCl2 ΔH<0
4NH3↑+SiH4↑+2MgCl2 ΔH<0

①NH4Cl中的化学键类型有______________________,SiH4的电子式为______________。
②上述生产硅烷的过程中液氨的作用是_______________________________________
________________________________________________________________________。
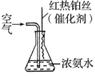
③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式________________________________________________________________________,
实验室可利用如右图所示装置完成该反应。在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是______________。
(2)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为__________________________________________。将0.184 g三硅酸镁加入
到50 mL 0.1 mol·L-1盐酸中,充分反应后,滤去沉淀,用0.1 mol·L-1 NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8·nH2O中n的值为__________。(注:Mg2Si3O8的摩尔质量为260 g·mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿,现把白锡制成的器皿放在0 ℃、100 kPa的室内存放,它会不会变成灰锡而不能再继续使用?
已知:在0 ℃、100 kPa条件下白锡转化为灰锡的反应焓变和熵变分别为ΔH=-2 180.9 J·mol-1,ΔS=-6.61 J·mol-1·K-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:C2H4(g)+H2O(g)===C2H5OH(g) ΔH=-45.5 kJ·mol-1。
乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。
下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中nH2O∶nC2H4=1∶1)。
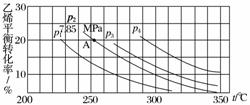
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=________________________________________________________________________
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强(p1、p2、p3、p4)的大小顺序为__________,理由是________________________________________________________________________
________________________________________________________________________。
③气相直接水合法常用的工艺条件为磷酸/硅藻土为催化剂,反应温度290 ℃、压强6.9 MPa,nH2O∶nC2H4=0.6∶1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有________________________、________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2NO(g)+O2(g)2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。
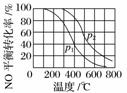
①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
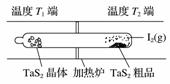
T℃时,在V L恒容密闭容器中加入足量的TaS2(s)和1 mol I2(g),发生反应TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0。t min时生成0.1 mol TaI4。下列说法中正确的是( )
A.0~t min内,v(I2)=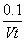 mol· L-1·min -1
mol· L-1·min -1
B.若T ℃时反应的平衡常数K=1,则平衡时I2的转化率为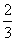
C.图中制备TaS2晶体过程中循环使用的物质是S2(g)
D.图中T1端得到纯净TaS2晶体,则温度T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是
C8H10(g)C8H8(g)+H2(g) ΔH=125 kJ·mol-1
Ⅰ.某温度下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20 min时,该段时间内H2的平均反应速率是________。
(2)该温度下,该反应的化学平衡常数是____________。
(3)若保持其他条件不变,用0.40 mol H2(g)和0.40 mol C8H8(g)合成C8H10(g),当有30 kJ热量放出时,该反应中H2的转化率是________________。此时,该反应是否达到了平衡状态?________(填“是”或“否”)。
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。
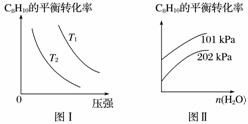
(4)由图Ⅰ可知,T1________T2(填“大于”、“小于”或“等于”)。
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将________(填“越大”、“越小”或“不变”),原因是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Zn2+的4s和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为( )
A.直线形 B.平面正方形
C.正四面体形 D.正八面体形
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.以非极性键结合起来的双原子分子一定是非极性分子
B.以极性键结合起来的分子一定是极性分子
C.非极性分子只能是双原子单质分子
D.非极性分子中,不一定含有非极性共价键
★ ★★
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com