
【题目】关于化合物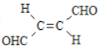 ,下列叙述正确的有( )
,下列叙述正确的有( )
A.分子间可形成氢键B.分子中既有极性键又有非极性键
C.分子中有7个![]() 键和1个
键和1个![]() 键D.C原子的杂化方式是sp2和sp3
键D.C原子的杂化方式是sp2和sp3
【答案】B
【解析】
A. 分子中形成氢键的条件为:必须同时存在氢原子和氟、氧、氮中的一种,氢原子和氟、氧、氮原子必须处在相邻的位置;
B. 共用电子对偏向一方的是极性键,没有发生偏移的是非极性键;
C. 共价单键均为![]() 键,双键中一个是
键,双键中一个是![]() 键一个是
键一个是![]() 键;
键;
D. 碳碳双键和碳氧双键均为sp2杂化;
A. 该有机物分子中含-CHO,O和H没有处于相邻的位置,不能形成氢键,A项错误;
B. C、H与C、O之间形成极性键,而C、C之间形成非极性键,则分子中既有极性键又有非极性键,B项正确;
C. 双键中含1个![]() 键和1个
键和1个![]() 键,单键均为
键,单键均为![]() 键,则分子中有9个
键,则分子中有9个![]() 键和3个
键和3个![]() 键,C项错误;
键,C项错误;
D. 分子中形成的碳碳双键和碳氧双键,杂化方式为sp2,D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】中国科学家运用穿山甲的鳞片特征,制作出具有自我恢复性的防弹衣,具有如此神奇功能的是聚对苯二甲酰对苯二胺(G)。其合成路线如下:
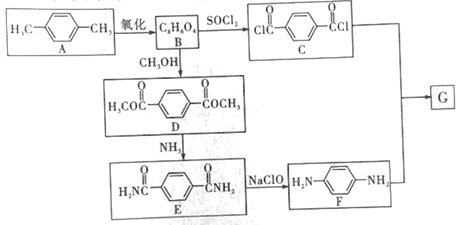
回答下列问题:
(1)A的化学名称为___。
(2)B中含有的官能团名称为___,B→C的反应类型为___。
(3)B→D的化学反应方程式为___。
(4)G的结构简式为___。
(5)芳香化合物H是B的同分异构体,符合下列条件的H的结构共有___种(不考虑立体异构),其中核磁共振氢谱有四组峰的结构简式为___。
①能与NaHCO3溶液反应产生CO2;②能发生银镜反应
(6)参照上述合成路线,设计以![]() 为原料(其他试剂任选),制备
为原料(其他试剂任选),制备![]() 的合成路线:___。
的合成路线:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分生成物与反应条件已略去)。B、D、H 是气体,B 是单质,D 能使湿润的红色石蕊试纸变蓝;C、G 是生活中的常见金属,工业上用反应①制备 C;K、F 是固体,其中F 是一种红色涂料的主要成分。
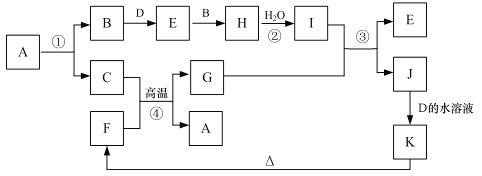
(1)K的化学式为___________;D 的电子式为____________。
(2)写出反应②的离子方程式: ___________。
(3)写出反应③的化学方程式,并用单线桥标出电子转移的方向和数目:_____________。
(4)物质J 常用作催化剂,媒染剂,放射性物质吸附剂。从J的溶液得到J的晶体的操作依次为_____________、冰水洗涤、减压烘干。冰水洗涤的目的___________。
(5)反应③常通过微热来加快反应的速率,加热时温度不能过高的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯![]() ,熔点:
,熔点:![]() ,沸点:
,沸点:![]() 为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。是有机物合成中的重要试剂,常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示
为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。是有机物合成中的重要试剂,常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示![]() 其中III、IV中均为浓硫酸
其中III、IV中均为浓硫酸![]() :
:
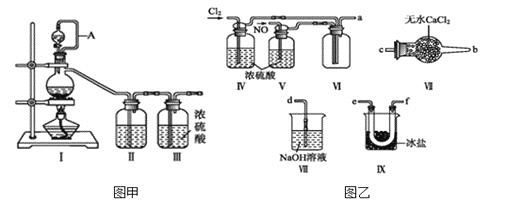
(1)用图甲中装置制备纯净干燥的原料气,补充下表中所缺少的药品。
| 装置Ⅰ | 装置Ⅱ | |
| 烧瓶中 | 分液漏斗中 | |
制备纯净 |
| 浓盐酸 |
|
制备纯净NO | Cu | 稀硝酸 |
|
(2)将制得的NO和![]() 通入图乙对应装置制备NOCl。
通入图乙对应装置制备NOCl。
![]() 装置连接顺序为
装置连接顺序为![]() ________
________![]() 按气流自左向右方向,用小写字母表示
按气流自左向右方向,用小写字母表示![]() 。
。
![]() 装置Ⅳ、Ⅴ除可进一步干燥NO、
装置Ⅳ、Ⅴ除可进一步干燥NO、![]() 外,还可以通过观察气泡的多少调节两种气体的流速。
外,还可以通过观察气泡的多少调节两种气体的流速。
![]() 有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、
有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、![]() 通入装置Ⅴ中,你同意此观点吗?_______
通入装置Ⅴ中,你同意此观点吗?_______![]() 填“同意”或“不同意”
填“同意”或“不同意”![]() ,原因是___________。
,原因是___________。
![]() 实验开始的时候,先通入氯气,再通入NO,原因为________________________。
实验开始的时候,先通入氯气,再通入NO,原因为________________________。
(3)有人认为多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置 ______;
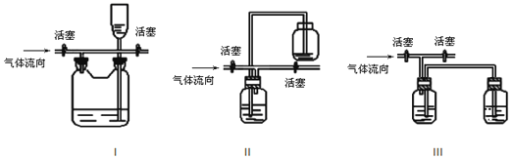
(4)装置Ⅶ吸收尾气时,NOCl发生反应的化学方程式为_______________________。
(5)有人认为装置Ⅶ中氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置Ⅶ氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:__________________________________。
(6)制得的NOCl中可能含有少量![]() 杂质,为测定产品纯度进行如下实验:称取
杂质,为测定产品纯度进行如下实验:称取![]() 样品溶于
样品溶于![]() 溶液中,加入几滴
溶液中,加入几滴![]() 溶液作指示剂,用足量硝酸酸化的
溶液作指示剂,用足量硝酸酸化的![]() 溶液滴定至产生砖红色沉淀,消耗
溶液滴定至产生砖红色沉淀,消耗![]() 溶液
溶液![]() 。则该样品的纯度为__________
。则该样品的纯度为__________![]() 保留1位小数
保留1位小数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeCl3溶液呈_______性,原因是__________(用离子方程式表示)。把FeCl3溶液蒸干后并灼烧,最后得到的主要固体产物是_________。
(2)在25℃下,将a mol·L-1的CH3COOH与0.01 mol·L-1的NaOH等体积混合,反应平衡时溶液中c(CH3COO-)=c(Na+),则溶液显______ (填“酸”、“碱”或“中”)性;用含a的代数式表示CH3COOH的电离常数Ka=__________ 。
(3)已知298 K和101 kPa条件下:
N2(g)+3H2(g)=2NH3(g) ΔH1
2H2(g)+O2(g)=2H2O(l) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(l) ΔH4
则N2H4(l)的标准燃烧热ΔH=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
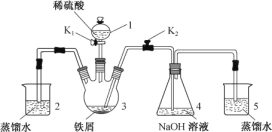
【题目】某同学设计如图装置(气密性已检查)制备Fe(OH)2白色沉淀。
请回答:
(1) 仪器1的名称________。装置5的作用________。
(2) 实验开始时,关闭K2,打开K1,反应一段时间后,再打开K2,关闭K1,发现3中溶液不能进入4中。请为装置作一处改进,使溶液能进入4中________。
(3) 装置改进后,将3中反应后溶液压入4中,在4中析出了灰绿色沉淀。从实验操作过程分析没有产生白色沉淀的原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一真空密恒容闭容器中盛有1mol PCl5,加热到200℃时发生反应:PCl5(g)![]() PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2mol PCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是
PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2mol PCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是
A.M>NB.M<NC.M=ND.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物用途非常广泛。
(1)已知赤铁矿还原冶炼时是逐级进行的,已知:
(a) 3Fe2O3(s)+CO(g) ![]() 2Fe3O4(s)+CO2(g)
2Fe3O4(s)+CO2(g) ![]() H = a kJ·mol-1
H = a kJ·mol-1
(b) Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g) ![]() H =b kJ·mol-1
H =b kJ·mol-1
(c) Fe3O4(s)+CO(g) ![]() 3FeO(s)+CO2 (g)
3FeO(s)+CO2 (g) ![]() H = c kJ·mol-1
H = c kJ·mol-1
①上述反应(a)平衡常数表达式为K=___________________。
②反应FeO(s)+CO(g) ![]() Fe(s)+CO2(g)
Fe(s)+CO2(g) ![]() H =__________kJ·mol-1(用含a、b、c的代数式表示)。
H =__________kJ·mol-1(用含a、b、c的代数式表示)。
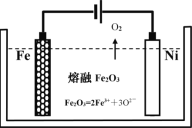
(2)用类似冶炼铝的方法, 在600~1000℃时电解熔融的Fe2O3冶炼铁(装置示意图如图),该法除消耗能量较少外,另一最突出的优点是__________________________________;电解时阳极发生的电极反应为____________。
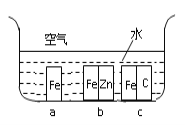
(3)生铁在自然界中可发生析氢腐蚀和吸氧腐蚀,析氢腐蚀的负极的电极反应式为_________;如图所示,纯铁处于a、b、c三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填字母)_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com