
(12分)【化学——有机化学基础】
饱受争议的PX项目是以苯的同系物F为原料的化工项目。F中苯环上的取代基是对位关系。用质谱法测得F的相对分子质量为106,A的相对分子质量为92,A与F属于同系物。下图是以A、F为原料制得J的合成路线图。
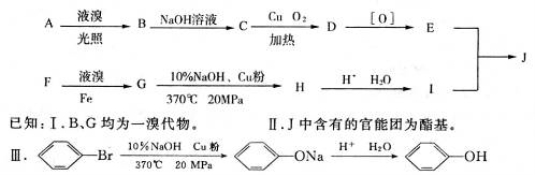
(1)写出F的结构简式:______________。
(2)C所含官能团的名称是____________。
(3)C→D的反应类型属于_____________;F→G的反应类型属于____________。
(4)写出满足以下三个条件的I的同分异构体的结构简式:______________。
i属于芳香族化合物 ii不与金属钠发生化学反应iii核磁共振氢谱有4组峰,且峰面积比为3:3:2:2。
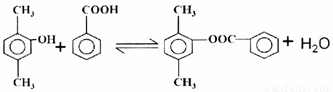
(5)写出E和I反应最终生成J的化学方程式:____________________________________。
(12分)
(1)CH3— —CH3(2分)
—CH3(2分)
(2)(醇)羟基(2分)
(3)氧化反应(2分);取代反应(2分)
(4)CH3— —OH3(2分
—OH3(2分
(5) (2分)
(2分)
【解析】
试题分析:F为苯的同系物,相对分子质量为106,根据苯的同系物的通式可得n=8,因为F中苯环上的取代基是对位关系,所以F为CH3— —CH3;A与F属于同系物,A的相对分子质量为92,则A为:
—CH3;A与F属于同系物,A的相对分子质量为92,则A为: —CH3;A液溴在光照条件下发生—CH3上的取代反应,生成的B为
—CH3;A液溴在光照条件下发生—CH3上的取代反应,生成的B为 —CH2Br,B与NaOH溶液发生水解反应生成的C为:
—CH2Br,B与NaOH溶液发生水解反应生成的C为: —CH2OH,C在Cu催化下与O2反应生成的D为:
—CH2OH,C在Cu催化下与O2反应生成的D为: —CHO,D继续氧化得到的E为
—CHO,D继续氧化得到的E为 —COOH,F与液溴在Fe催化下发生苯环上的取代反应,生成的G为:
—COOH,F与液溴在Fe催化下发生苯环上的取代反应,生成的G为: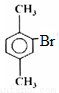 ,根据题目所给信息G在10%NaOH|Cu粉等条件下生成的H为
,根据题目所给信息G在10%NaOH|Cu粉等条件下生成的H为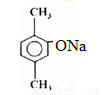 ,H在H+、H2O条件下转化为I:
,H在H+、H2O条件下转化为I: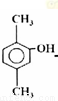 ,E、I通过酯化反应可得J。
,E、I通过酯化反应可得J。
(1)根据上述推断可知F的结构简式:CH3— —CH3
—CH3
(2)C的结构简式为: —CH2OH,含有的官能团为:(醇)羟基。
—CH2OH,含有的官能团为:(醇)羟基。
(3)C→D羟基被氧化为醛基,所以反应类型属于氧化反应;F→G发生苯环上的取代,所以反应类型属于取代反应。
(4)i属于芳香族化合物,含有苯环;ii不与金属钠发生化学反应,不能羟基和羧基;iii核磁共振氢谱有4组峰,且峰面积比为3:3:2:2,所以该同分异构体为CH3— —OH3
—OH3
(5)E、I通过酯化反应制取J,所以化学方程式为: 。
。
考点:本题考查有机合成的分析与推断、同分异构体、反应类型的判断、化学方程式的书写。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014山东省济宁市3月质量检测高二化学试卷(解析版) 题型:选择题
主链含5个碳原子,有甲基、乙基2个支链的烷烃有:( )
A. 2种 B. 3种 C. 4种 D. 5种
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市高二年级第二学期阶段考试化学试卷(解析版) 题型:选择题
某同学在实验报告中记录下列数据,其中正确的( )
A.用25mL量筒量取18.63mL盐酸
B.用托盘天平称取12.15克食盐
C.标准的NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液32.30mL
D.用广泛pH试纸(1~14)测得某溶液pH为5.5
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市高二5月月考化学试卷(解析版) 题型:选择题
乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂键的说明,正确的是( )
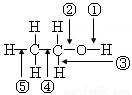
A.与金属钠作用时,键②断裂
B.与浓硫酸共热至170 ℃时,键①和⑤断裂
C.与乙酸、浓硫酸共热时,键①断裂
D.在铜催化下和氧气反应时,键①和②断裂
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市高二5月月考化学试卷(解析版) 题型:选择题
下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是 ( )
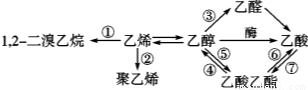
A.反应①是加成反应
B.只有反应②是加聚反应
C.只有反应⑦是取代反应
D.反应④⑤⑥是取代反应
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济南市高三5月针对性训练理综化学试卷(解析版) 题型:简答题
(18分)碱金属元素的单质及其化合物被广泛应用于生产、生活中。
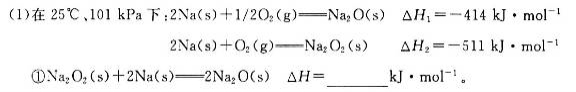
②一定量的Na在足量O2中充分燃烧,参加反应的O2体积为5.6 L(标准状况),则该反应过程中转移电子的数目为_________。
(2)金属锂广泛应用于化学电源制造,锂水电池就是其中的一种产品。该电池以金属锂和 钢板为电极材料,以LiOH为电解质,加入水即可放电。
总反应为:2Li+2H2O=2LiOH+H2↑
①锂水电池放电时,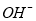 向_________极移动。
向_________极移动。
②写出该电池放电时正极的电极反应式:_________________。
③电解熔融LiCl可以制备金属Li。但LiC1熔点在873 K以上,高温下电解,金属Li产量极低。经过科学家不断研究,发现电解LiCl—KCl的熔盐混合物可以在较低温度下生成金属Li。
你认为,熔盐混合物中KCl的作用是_________________________________________。
写出电解该熔盐混合物过程中阳极的电极反应式:______________________________。
(3)最新研究表明,金属钾可作工业上天然气高温重整的催化剂,有关反应为:
 。一定温度下,向2 L容积不变的密闭容器中充入4 mol
。一定温度下,向2 L容积不变的密闭容器中充入4 mol 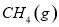 和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。
和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。

①0~10 min内用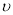 (CO)表示的化学反应速率为_________。
(CO)表示的化学反应速率为_________。
②下列叙述中,能够证明该反应已达到平衡状态的是_________(填序号)。
a.生成3 molH-H键的同时有4 molC-H键断裂
b.其他条件不变时,反应体系的压强保持不变
c.反应混合气体的质量保持不变
d.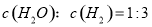
③此温度下,该反应的化学平衡常数K=_________mo12·L-2。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济南市高三5月针对性训练理综化学试卷(解析版) 题型:选择题
全国“两会”期间,山东代表提出“向污染宣战”的倡议。下列做法中,不符合“治理污染、保护环境”这一理念的是
A.大力发展工业除尘技术,严控PM2.5
B.向含重金属离子的工业废水中加入明矾,然后再将废水排放
C.将炼铁时产生的高炉矿渣加工成多种工业原料
D.推进燃油的品质升级,致力于缓解雾霾产生
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省枣庄市2013-2014学年高三3月调研考试理综化学试卷(解析版) 题型:简答题
(22分)研究碳及其化合物的性质和用途是中学化学的任务之一。
I.某兴趣小组在实验室中制备碳酸钠溶液。方案如下:步骤一,取25 mL一定浓度的NaOH溶液,通人CO2气体至过量;步骤二,加热煮沸步骤一所得溶液;步骤三,另取25 mL相同浓度的NaOH溶液与步骤二所得溶液混合,即得碳酸钠溶液。
(1)完成步骤一可选的化学试剂有:稀盐酸、NaOH溶液、大理石、饱和碳酸钠溶液、稀硫酸、饱和碳酸氢钠溶液等,需要的装置如下所示。
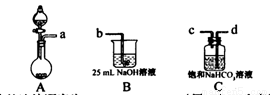
①各装置正确的连接顺序为 (用a、b、c、d表示)。
②检查整套装置气密性的方法是 。
③装置A中常用药品为 ;装置C中化学药品的作用是 。
(2)写出步骤三中发生反应的离子方程式 。
(3)有同学提出“步骤二”没有必要,请你简述自己的看法 。
Ⅱ.实验室用纯碱和盐酸处理某种蛇纹石(已知蛇纹石中含有MgO、SiO2.CaO、Fe2O3、Al2O3等氧化物)模拟制备氧化镁的流程如下:
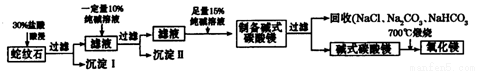
(1)过滤需要的玻璃仪器有 。
(2)沉淀Ⅱ的成分为 ,请用离子方程式表示生成沉淀的过程 (写出一个即可)。
(3)纯碱溶液中所有离子浓度的大小关系为 。
(4)已知l0%的纯碱溶液密度为1.06g/cm3,则其物质的量浓度为____ ,
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高二化学试卷(解析版) 题型:填空题
(15分)写出下列反应的化学方程式:
(1)乙醛和银氨溶液反应 ;
(2)苯酚溶液和浓溴水的反应 ;
(3)1-溴丙烷和NaOH醇溶液共热 ;
(4)用苯制溴苯的反应 ;
(5)乙醇的催化氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com