
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
分析 I.a.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动;
b.反应前后气体的物质的量不变,增大压强平衡不移动;
c.加入合适的催化剂,平衡不移动;
d.移出部分CO2,平衡向正反应移动;
e.粉碎矿石,使其与平衡混合气体充分接触,平衡不移动;
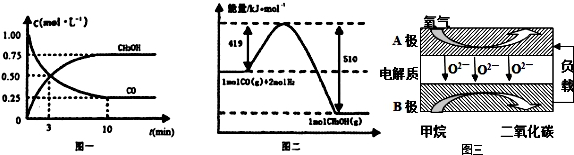
Ⅱ(1)根据v=$\frac{△c}{△t}$计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);
(2)A.甲、乙是完全等效平衡,平衡时各组分的浓度相等;
B.丙与甲相比,等效为在甲平衡的基础上再加入1mol CO和2mol H2,压强增大,平衡向正反应方向移动,丙中反应物的转化率大于甲;
C.丙与甲相比,等效为在甲平衡的基础上再加入1mol CO和2mol H2,压强增大,平衡向正反应方向移动,转化率增大,但2α1不一定等于α3 ;
D.CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,乙中平衡时甲醇的转化率为α2,乙中平衡时CO的物质的量为α2mol,甲与乙是完全等效平衡,平衡时对应各组分的含量完全相同;
Ⅲ(1)B为负极,总反应式为CH4+2O2+=CO2+2H2O,正极反应式为:2O2+8e-=4O2-,两式相减可得负极电极反应式;
(2)开始阶段发生反应:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令是氢气为xmol,根据电子转移守恒列方程计算,再根据电子转移守恒计算消耗的甲烷.
解答 解:Ia.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故a错误;
b.反应前后气体的物质的量不变,增大压强平衡不移动,CO的平衡转化率不变,故b错误;
c.加入合适的催化剂,平衡不移动,故c错误;
d.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故d正确;
e.粉碎矿石,使其与平衡混合气体充分接触,可以加快反应速率,但平衡不移动,故e错误;
故答案为:d;
Ⅱ(1)由图可知,达到平衡时甲醇的浓度变化为0.75mol/L,则v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/(L.min),速率之比等于化学计量数之比,v(H2)=2v(CH3OH)=0.15mol/(L•min),
故答案为:0.15mol/(L•min);
(2)A.甲、乙是完全等效平衡,平衡时各组分的浓度相等,所以平衡时甲醇的浓度c1=c2,故A正确;
B.丙与甲相比,等效为在甲平衡的基础上再加入1mol CO和2mol H2,压强增大,平衡向正反应方向移动,丙中反应物的转化率大于甲,丙中参加反应的CO大于甲中的2倍,故2Q1<Q3,故B错误;
C.丙与甲相比,等效为在甲平衡的基础上再加入1mol CO和2mol H2,压强增大,平衡向正反应方向移动,丙中反应物的转化率大于甲,但2α1不一定等于α3 ,故C错误;
D.甲与乙是完全等效平衡,平衡时对应各组分的含量完全相同,CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,乙中平衡时甲醇的转化率为α2,乙中平衡时CO的物质的量为α2mol,故(1-α1)=α2,整理得α1+α2=1,故D正确;
故选AD;
Ⅲ(1)总反应式为CH4+2O2+=CO2+2H2O,正极反应式为:2O2+8e-=4O2-,两式相减,负极反应为:CH4-8e-+4O2-=CO2+2H2O,
故答案为:CH4-8e-+4O2-=CO2+2H2O;
(2)硫酸铜的物质的量=0.1L×1mol/L=0.1mol,开始阶段发生反应:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令是氢气为xmol,根据电子转移守恒,则:0.1mol×2+2x=4x,解得x=0.1,
根据电子转移守恒,可知消耗的甲烷物质的量=$\frac{0.1mol×4}{8}$=0.05mol,故消耗甲烷的体积=0.05mol×22.4L/mol=1.12L,
故答案为:1.12L.
点评 本题综合考查了化学平衡计算、等效平衡等,Ⅱ中等效平衡的计算,为该题的难点,也是易错点,注意理解等效平衡问题,思维量大,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | △H1<0 | B. | △H2>0 | C. | △H2=△H3-△H1 | D. | 2△H4<△H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因乙烯和苯分子中都含有碳碳双键,故而它们都能使溴水褪色 | |
| B. | 鉴别己烯和甲苯,可以通过分别向它们中滴入酸性KMnO4溶液 | |
| C. | 高分子材料、盐酸、水煤气、沼气、石油等是混合物,而C3H8一定是纯净物 | |
| D. | 将乙烯通入溴水中,溴水褪色,是因为发生了取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素在一定条件下均能水解 | |
| B. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物,有固定的熔点、沸点 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油,可以实现厨余废物合理利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol | B. | 2 mol | C. | 7 mol | D. | 8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a为正极,b为负极 | |
| B. | 负极反应式为2H2O+SO2-2e-=SO42-+4H+ | |
| C. | 电子从b极向a极移动 | |
| D. | 生产过程中H+由b电极区通过质子膜向a电极区运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子组成满足CnH2n-6的化合物一定属于芳香烃 | |
| B. | 甲苯与混酸作用一次可向苯环中引入三个-NO2,而苯只能引入一个-NO2,说明甲苯的化学活泼性比苯强 | |
| C. | 二甲苯有四种同分异构体,它们被高锰酸钾酸性溶液氧化后都能生成二元芳香酸 | |
| D. | 2,4,6三硝基甲苯,俗称TNT,是一种黄色烈性炸药. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应为:O2+2H2O+4e-═4OH- | |
| B. | 负极反应为:2H2+4OH--4e-═4H2O | |
| C. | 电池工作时溶液中的阴离子移向正极 | |
| D. | 电池工作时负极区pH升高,正极区pH下降 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com