
常温下,将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1: 2的体积比混合,所得溶液的pH=12。用上述NaOH溶液滴定pH=3的某一元弱酸溶液20mL,达到终点时消耗NaOH溶液13mL,试求:
(1)NaOH溶液的物质的量浓度为_____________mol/L
(2)此一元弱酸的物质的量浓度为___________mol/L
(3)求此条件下该一元弱酸的电离平衡常数为 ___________。
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源:2017届黑龙江牡丹江第一高级中学高三12月月考化学卷(解析版) 题型:选择题
25℃时,0.1 mol/L下列溶液的pH如下表,有关比较正确的是
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NaCl | CH3COONH4 | NaClO | NaHCO3 | Na2CO3 |
pH | 7.0 | 7.0 | 10.3 | 8.3 | 11.6 |
A.酸性的相对强弱:HClO<HCO3-
B.由水电离产生的c(H+):① = ②
C.溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-)
D.在④⑤溶液等体积混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上期中化学试卷(解析版) 题型:实验题
从海带中提取碘,有甲、乙两种实验方案如下:
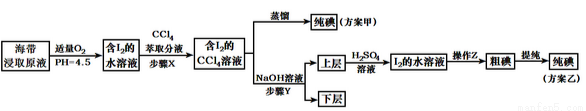
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。请回答:
(1)步骤X使用分液漏斗前须检漏,检漏方法为_________。
(2)用右图所示装置进行蒸馏。指出右图所示实验装置中的任意两处错误:
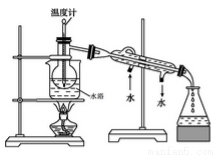
①___________;②__________。
(3)进行上述操作时,使用水浴加热更好的原因是___________;最后碘晶体在__________里聚集。
(4)下列有关步骤Y的说法,正确的是________。
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
(5)方案乙在上层溶液中加入H2SO4溶液得到I2的水溶液发生的反应方程式是:_____________;
(6)操作Z的名称是____________。
(7)工业中采用方案乙从海带中提取碘,方案甲中采用蒸馏不合理,理由是______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上期中化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.金属钠和水反应:Na+2H2O=Na++2OH-+H2↑
B.用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH-=SO32-+H2O
C.硫酸铵溶液和氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
D.碳酸氢钠溶液和过量的澄清石灰水混合:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上期中化学试卷(解析版) 题型:选择题
分类方法在化学学科的发展中起到重要的作用,下列分类标准合理的是
A.根据碳酸钠溶于水呈碱性,碳酸巧既属于盐,又属于碱
B.根据物质是否能导电,将物质分为电解质、非电解质
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据反应过程中元素化合价是否发生变化,将化学反应分为氧化还原反应和非氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
25℃时,在等体积的①pH=0的H2SO4溶液②0.05 mol·L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
A.1∶10∶1010∶109 B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109 D.1∶10∶104∶109
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
pH相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量A=B ④反应
过程的平均速率B>A ⑤盐酸里有锌剩余 ⑥醋酸里有锌剩余
A.③④⑥ B.②③⑥ C.③④⑤ D.①②⑤
查看答案和解析>>
科目:高中化学 来源:2017届安徽师大附中高三上新课标模拟化学卷(解析版) 题型:推断题
【化学——选修3:物质结构与性质】周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z2+基态核外电子排布式为:_______________________。
(2)YX4-的空间构型是:_________,HYX4酸性比HYX2强,其原因是:_______________。
(3)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为:________________ (H为氢元素,下同)
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是:____________。A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道进
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如下图所示 (黑点代表Z原子)。

①该晶体的化学式为____________。
②已知该晶体的密度为ρg·cm-3,阿伏加徳罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为___________㎝(只写计算式)(Z原子位于体对角线上)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考三化学试卷(解析版) 题型:填空题
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)煤化工通常通过研究不同温度下的平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:
CO(g)+H2O(g) H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
①若在500℃时进行反应,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为 。
②800℃时,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO) =0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L, c(H2)=0.05mol/L ,则
=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L, c(H2)=0.05mol/L ,则 反应开始时,H2的消耗速率比生成速率 (填“大”、“小”或“不能确定”)。
反应开始时,H2的消耗速率比生成速率 (填“大”、“小”或“不能确定”)。
(2)2SO2(g)+O2(g) 2SO3(g)反应过程中的能量变化如图所示:又已知1molSO2
2SO3(g)反应过程中的能量变化如图所示:又已知1molSO2 (g)氧化为1molSO3(g)的ΔH=-99 kJ·mol-1,请回答问题:
(g)氧化为1molSO3(g)的ΔH=-99 kJ·mol-1,请回答问题:
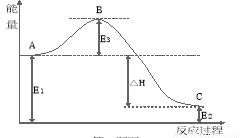
该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”或“降低” )△H (填“变大”、“变小”或“不变”);
(3)已知某反应的平衡常数表达式为: ,它所对应反应的化学方程式为
,它所对应反应的化学方程式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com