
【题目】硫及其化合物广泛分布于自然界中,硫酸工业在国民经济中占有极其重要的地位,运用相关原理回答下列问题:
(1)硫酸生产中,根据化学平衡原理来确定的条件或措施有_______(填序号)。
A.矿石加入沸腾护之前先粉碎
B.使用V2O5作催化剂
C.接触室中不使用很高的温度
D.净化后炉气中要有过量的空气
E.接触氧化在常压下进行
(2)若实验室在537℃、1.01×105Pa和催化剂存在条件下,向某密闭容器中充入2mol SO2和2mol O2,此时体积为10L,在温度和压强不变条件下20分钟后反应达到平衡,SO3体积分数为0.5。
①该温度下,从反应开始至平衡时氧气的平均反应速率是_______;
②该温度下,反应2SO2(g)+O2(g)![]() 2SO3(g)的平衡常数的值为_______________。
2SO3(g)的平衡常数的值为_______________。
(3)工业上冶炼铜主要以黄铜矿(主要成分CuFeS2)为原料,经过多歩反应将铜元素还原为铜。其中有一步为:2Cu2S+3O2(g) === 2Cu2O+2SO2。试从反应的自发性判断此反应的ΔH________0 (填“>”、“=”或“<”)。
(4)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。如图,是电解产生多硫化物的实验装置:
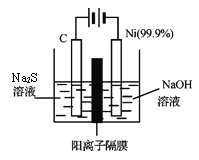
①已知阳极的反应为:(x+1)S2-=== Sx+S2-+2xe-,则阴极的电极反应式是:__________。当反应转移xmol电子时,产生的气体体积为_________(标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子方程式表示):____________。溶液中离子浓度由大到小的顺序____________。
【答案】 CD 4×10-3mol/(L·min) 133.3 < 2H2O+2e-=== 2OH-+H2↑ 11.2xL 2S2-+O2+2H2O === 2S↓+4OH- c(Na+) > c(S2-) > c(OH-) > c(HS-) > c(H+)
【解析】试题分析:以硫的化合物中黄铜矿冶炼、SO2的催化氧化、硫酸的工业生产、电解法制取多硫化物和硫化钠溶液的配置为载体,考查考生对化学平衡的移动、化学反应速率和化学平衡常数的计算、化学反应的自发性、电解原理及其简单计算、盐类的水解、离子浓度大小的比较等知识的掌握情况,考查考生利用化学解决实际问题的能力。考点多而分散,解提过程中需要合理调动已有知识,准确应用相关原理进行分析解答。
解析:(1)硫酸生产中,A、矿石加入沸腾炉之前先粉碎是为了增大矿石与空气的接触面积,促进矿石更快、更充分燃烧,因此A错误。B、催化剂与化学平衡移动无关,B错误。C、接触室中SO2的催化氧化是一个体积减小的放热反应,不使用很高温度是从化学平衡角度,放热反应降低温度时平衡正向移动,从而提高SO2的转化率,C正确。D、净化后炉气中含有过量空气时,过量的氧气能够使接触室中化学平衡正向移动,提高SO2的转化率,D正确。E、接触室中的平衡体系加压时平衡正向移动,所以“在常压下进行”一定不是从化学平衡角度采取的措施,而是考虑设备的制造成本,E错误。正确答案CD。(2)设反应消耗O2 x mol,则消耗SO2 2x mol,反应生成SO3 2x mol,平衡体系中气体总量(2-2x)+(2-x)+2x=4-x mol,此时SO3体积分数为![]() ,x=0.8mol。v(O2)=
,x=0.8mol。v(O2)=![]() ,该温度下反应平衡常数为
,该温度下反应平衡常数为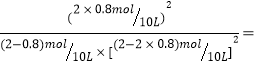 133.3。答案:4×10-3mol/(L·min)、133.3 。(3)反应后气体物质的量减小,熵减小△S<0,反应能够自发进行,因此△G<0。△G=△H-T△S,所以△H<0。答案:<。(4)①溶液中主要阳离子是Na+和H+,阳极电极C是一种惰性电极,所以H+在阳极放电产生H2,电极反应式为2H++2e-=H2↑。当转移x mol电子时,标准状况下产生H2:
133.3。答案:4×10-3mol/(L·min)、133.3 。(3)反应后气体物质的量减小,熵减小△S<0,反应能够自发进行,因此△G<0。△G=△H-T△S,所以△H<0。答案:<。(4)①溶液中主要阳离子是Na+和H+,阳极电极C是一种惰性电极,所以H+在阳极放电产生H2,电极反应式为2H++2e-=H2↑。当转移x mol电子时,标准状况下产生H2:![]() 答案:2H++2e-=H2↑或2H2O+2e-=2OH-+H2↑ 、11.2x L。②Na2S中-2价S元素具有较强的还原性,Na2S溶液配制的过程中可能被空气中氧气氧化2Na2S+O2+2H2O=4NaOH+2S↓,所以通常是在氮气气氛下溶解。Na2S溶于水后,c(Na+)>c(S2-),S2-+H2O
答案:2H++2e-=H2↑或2H2O+2e-=2OH-+H2↑ 、11.2x L。②Na2S中-2价S元素具有较强的还原性,Na2S溶液配制的过程中可能被空气中氧气氧化2Na2S+O2+2H2O=4NaOH+2S↓,所以通常是在氮气气氛下溶解。Na2S溶于水后,c(Na+)>c(S2-),S2-+H2O![]() HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O![]() H2S+OH-,且第一步水解会抑制第二步水解,所以第一步水解程度更大,则c(S2-) > c(OH-) > c(HS-) > c(H+)。答案:2S2-+O2+2H2O = 2S↓+4OH- 、c(Na+) > c(S2-) > c(OH-) > c(HS-) > c(H+)。
H2S+OH-,且第一步水解会抑制第二步水解,所以第一步水解程度更大,则c(S2-) > c(OH-) > c(HS-) > c(H+)。答案:2S2-+O2+2H2O = 2S↓+4OH- 、c(Na+) > c(S2-) > c(OH-) > c(HS-) > c(H+)。


科目:高中化学 来源: 题型:
【题目】一种光化学电池的结构如右图,当光照在表面涂有氯化银的银片上时,发生反应:AgCl(s) ![]() Ag(s)+Cl(AgCl), [Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态。下列说法正确的是
Ag(s)+Cl(AgCl), [Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态。下列说法正确的是

A. 光照时,电流由Y流向X
B. 光照时,当转移0.1mole-时在Pt电极上有0.05molCl2生成
C. 光照时,Cl-向Ag电极移动
D. 光照时,电池总反应为:AgCl(s) +Cu+(aq) ![]() Ag(s)+Cu2+(aq)+Cl-
Ag(s)+Cu2+(aq)+Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)![]() CH3OH(g) ΔH;下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH;下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①根据表中数据可判断ΔH 0 (填“>”、“=”或“<”)。
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
(2)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为: ,随着反应的不断进行溶液的pH (填“增大”“减小”或“不变”)。
(3)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为: ;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为 mL(标况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产生活中用途广泛。请回答:
I.在微生物作用下,土壤中的NH4+最终被O2氧化为NO3-,该反应的离子方程式为________。
Ⅱ.氨气是重要的化工原料。已知:25℃时,NH3·H2O的电离常数kb=1.79×10-5,该温度下,1.79mol/LNH4Cl溶液的pH约为_____________。
Ⅲ.汽车在行驶过程中有如下反应发生:
ⅰ.N2(g)+O2(g)![]() 2NO(g) △H=+180.7kJ/mol
2NO(g) △H=+180.7kJ/mol
ⅱ.2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-746.5kJ/mol
N2(g)+2CO2(g) △H=-746.5kJ/mol
(1)能表示CO燃烧热的热化学方程式为__________________。
(2)反应ⅱ在________(填“较高”或“较低”)温度下能自发进行。
(3)T温度时,向10L恒容密闭容器中充入2molNO和2molCO发生反应ii,5min时达到平衡,测得0~5min内该反应速率v(N2)=0.016mol·L-1·min-1。
①T温度时,该反应的平衡常数K=____________________。
②平衡时容器内压强与起始时容器内压强之比为_________________。
(4)一定条件下,向起始容积为5L的恒压密闭容器充入1molN2和1molO2发生反应i。O2的平衡转化率(α)与温度(T)的关系如图1所示;正反应的平衡常数(K)与温度(T)的关系如图2所示。
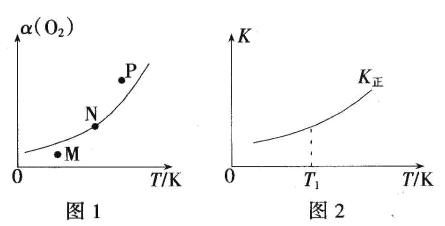
①图1中,M、N、P三点所对应的状态下,v(正)>v(逆)的是_______(填字母),理由为______。
②T1温度时,K正=1,则O2的平衡转化率为________(保留三位有效数字);在图2中画出逆反应平衡常数(K逆)与温度(T)的关系曲线。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:
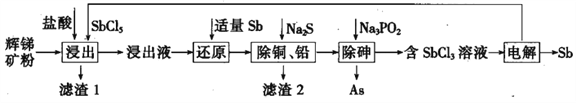
已知:① 浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有___________(填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为_________________。
(3)“还原”时,被Sb还原的物质为_____________(填化学式)。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于______;所加Na2S也不宜过多,其原因为_____________。
(5)“除砷”时有H3PO3生成,该反应的化学方程式为________________。
(6)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为_______。
(7)一种突破传统电池设计理念的镁-锑液态金属储能电池工作原理如图所示:

该电池由于密度的不同,在重力作用下分为三层,工作时中间层熔融盐的组成不变。充电时,C1-向_____(填“上”或“下”)移动;放电时,正极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)按官能团的不同,可以对有机物进行分类,请指出下列有机物的种类,填在横线上。
① ![]() __________; ②
__________; ② ![]() ___________;
___________;
③![]() ____________ ;④
____________ ;④![]() ;
;
⑤![]() ___________;
___________;
(2)某烃A 0.2 mol在氧气中充分燃烧后,生成化合物B、C各1 mol。
①烃A的分子式为 。
②若烃A不能使溴水褪色,但在一定条件下,能与Cl2发生取代反应,其一氯代物只有一种,则A的结构简式为 。
③若烃A能使溴水褪色,在催化剂作用下与H2加成,其加成产物分子中含有3个甲基,则A可能的结构简式为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等体积的两容器内分别充满由![]() N、l3C、18O三种原子构成的一氧化氮和一氧化碳,下列说法正确的是
N、l3C、18O三种原子构成的一氧化氮和一氧化碳,下列说法正确的是
A. 所含分子数和质量均不相同 B. 含有相同的分子数和电子数
C. 含有相同的质子数和中子数 D. 含有相同数目的中子、原子和分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质反应产物与物质的浓度有关的是( )
①铜与硝酸溶液 ②铜与氯化铁溶液 ③锌与硫酸溶液 ④铁与盐酸溶液
A. ①③ B. ③④ C. ①② D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海洋资源可以获得很多物质。如从海水中可以得到食盐等许多化工原料,可以通过蒸馏获得淡水,从海洋植物中提取碘等。
(一)从海水得到的粗盐中常含有杂质需要分离提纯,在除去悬浮物和泥沙之后,要用以下试剂①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、 Mg2+、SO42-。
(1)为有效除去Ca2+、 Mg2+、SO42-,加入试剂的合理顺序为___________。
a.先加 NaOH,后加Na2CO3,再加 BaCl2
b.先加NaOH,后加BaCl2,再加Na2CO3
C.先加BaCl2,后加NaOH,再加Na2CO3
(2)加入Na2CO3过程中发生反应的离子方程式为_______________________。
(3)判断试剂BaCl2己经足量的方法是_______________________。
(二)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:
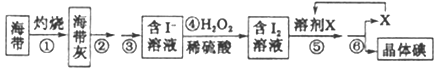
(1)实验时灼烧海带应在___________(填仪器名称)内进行。
(2)步骤④中反应的离子方程式是_______________。
(3)步骤⑤的实验操作为____________,应选用的一种溶剂X可以是____________。
a.苯、酒精 b.四氯化碳、苯 c.汽油、酒精
(4)步骤⑥的实验操作应选用下图中的_____________。
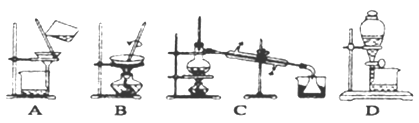
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com