
【题目】下列说法中,不正确的是( )
A.光合作用是将光能转化为化学能的有效途径
B.煤,石油,天然气都是可再生的化石燃料
C.用植物秸秆制沼气是有效利用生物质能的方式之一
D.开发氢能,太阳能,风能,生物质能等是实现“低碳生活”的有效途径
科目:高中化学 来源: 题型:
【题目】化学离不开实验,氨气和乙酸乙酯的制备分别是无机实验和有机实验的典型代表。请结合已有药品(选择性使用)和已学知识,回答下列问题:
(1)氨气的制备
现提供药品有:氯化铵固体、浓氨水、浓硫酸、碱石灰、水
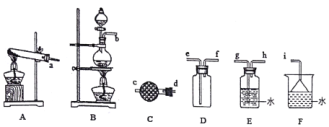
①该实验条件下,氨气的发生装置应选择上图中的_____(填大写字母)
②C的作用是_____。
③欲收集一瓶干燥的氨气,选择上图中的部分装置,其连接顺序为:发生装置→______(气流方向,用小写字母表示)。
(2)乙酸乙酯的制备
现提供药品有:乙酸、乙醇、浓硫酸、水、氢氧化钠溶液
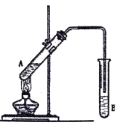
①浓硫酸在该反应中的作用是_____________
②该实验条件下,试管B内盛放的液体是____,可以判断该实验反应结束的现象为_______
③该实验制各少量的乙酸乙酯,产率往往偏低,除本身反应可逆外的原因可能还有(填一点即可):______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X、F是周期表中前四周期的七种元素,它们的原子序数依次增大。A元素的核外电子数和电子层数相等,是宇宙中最丰富的元素。B的最外层电子数为其内层电子数的2倍,D基态原子的s能级和p能级上电子数相等,E在短周期元素中第一电离能最小,X与D同主族,F在周期表的第八列。
(1)基态F原子的核外有_______种运动状态的电子。基态F3+的最外层电子排布式是________。
(2)B、C、D三种元素的电负性由大到小的排列是_______(填元素符号)。
(3)A、B、D形成BA2D型分子,该分子的空间构型为________。
(4)BC-中B原子的杂化轨道类型是_______,该离子中含有的σ键与π键的数目之比为_____。写出一种与该分子互为等电子体的单质分子的结构式_______。
(5)E2X与E2D相比较熔点较高的是______(填化学式),原因是__________。
(6)奧氏体是B溶解在F中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为_______。若晶体密度为dg.cm-3,则晶胞中最近的两个B原子的距离为______pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
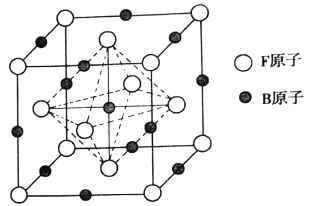
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g).一定条件下发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)△H 已知CH4的转化率与温度、压强的关系如图所示.回答下列问题: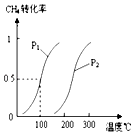
(1)100℃时平衡常数为 .
(2)图中的p1p2(填“<”、“>”或“=”),其理由是:
(3)若100℃时该可逆反应的平衡常数是K1 , 200℃该该可逆反应的平衡常数是K2 , 则K1K2(填“<”、“>”或“=”).其理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于不属于取代反应的是( )
A.油脂的水解
B.在一定条件下,苯与浓硝酸反应制取硝基苯
C.乙醛与氢气的反应
D.甲烷与氯气在光照条件下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应N2+3H2![]() 2NH3,是一个正反应为放热的可逆反应。下列说法正确的是
2NH3,是一个正反应为放热的可逆反应。下列说法正确的是
A. 使用合适的催化剂可以加快反应速率,提高生产效率
B. 生成物的总能量大于反应物的总能量
C. 将该反应设计成原电池,放出的热量不变
D. 达到平衡时,N2的浓度与NH3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仅根据题中图示得出的结论不合理的是( )
A | B | C | D | |
图示 |
|
|
|
|
结论 | HB为弱酸 | HF为弱电解质 | 溶解度:AgI<AgCl | 正反应△H>0 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q为原子序数依次增大的前四周期元素,X核外未成对电子数有2个,与其他元素均能形成二元化合物;Y是地壳中含量最多的金属元素;Z是遗传物质的组成元素之一;W内层电子数是最外层电子数的9倍;Q基态原子价层电子排布中成对电子数和未成对电子数相同,且成对电子数为最外层电子数的2倍。据此回答下列问题:
(1)Q的基态原子的价层电子排布式为___________________________。
(2)X、Y、Z、W四种元素中,电负性最大的是_________(填元素符号,下同);同周期元素中,第一电高能介于Y和Z之间的有__________________。
(3)Y和W的氯化物熔点高的是______(填化学式),原因是_____________________;与Z的低价氯化物互为等电子体的离子是_______(填离子符号)。
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图所示。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是___________,分子中氮原子的杂化类型有___________________。

(5)已知WX的密度为3.25g/cm3,单元晶胞边长481pm,经计算可确定该单元晶胞中含有____个WX,说明在形成晶体时,半径大的粒子先进行了_______方式的堆积,晶胞中距离W最近的X有_____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分,根据所给的10种元素,完成以下各小题..
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
二 | C | N | O | Ne | ||||
三 | Na | Mg | Al | Si | S | Cl |
(1)镁的原子结构示意图为 .
(2)H2SO4与HClO4中,酸性较强的是 .
(3)NaOH与Al (OH)3中,属于两性氢氧化物的是 . 它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com