
| A、14 | B、7 | C、6 | D、都有可能 |


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、m=1,n=5 |
| B、m=3,n=4 |
| C、m=5,n=1 |
| D、m=4,n=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、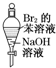 振荡后静置,上层溶液颜色保持不变 振荡后静置,上层溶液颜色保持不变 |
B、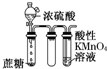 酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
C、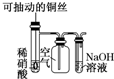 微热稀HNO3 片刻,溶液中有气泡产生,广口瓶气体由红棕色逐渐变无色 微热稀HNO3 片刻,溶液中有气泡产生,广口瓶气体由红棕色逐渐变无色 |
D、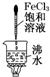 继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、观察K2SO4的焰色应透过蓝色的钴玻璃 |
| B、Na与NaCl在灼烧时火焰颜色相同 |
| C、可以用焰色反应来区别NaCl和KCl |
| D、焰色反应是元素的性质,属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(NH3)=0.001mol?L-1?s-1 |
| B、v(H2O)=0.001mol?L-1?s-1 |
| C、v(NO)=0.09mol?L-1?s-1 |
| D、v(O2)=0.05mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②④ | C、③④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R的最外层电子数为5 |
| B、R的氢化物的水溶液属于强酸 |
| C、RO3-中的R只能被还原 |
| D、R2在常温常压下一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 |
| B、在化学反应中,得电子越多的氧化剂,其氧化性就越强 |
| C、阳离子只能得电子被还原,阴离子只能失电子被氧化 |
| D、非金属单质在氧化还原反应中可能做氧化剂也可能做还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
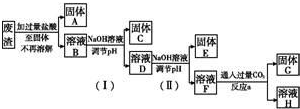
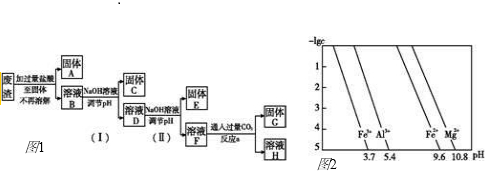
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com