
【题目】正硼酸(H3BO3)是一种白色晶体,有与石墨相似的层状结构,层内的H3BO3分子通过氢键相连(如图所示)。H3BO3在冷水中溶解度较小,可溶于热水,在水中的解离反应为:H3BO3+H2O![]() H++B(OH)4-。下列有关说法中正确的是( )
H++B(OH)4-。下列有关说法中正确的是( )
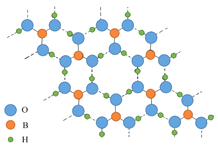
A.正硼酸晶体属于原子晶体
B.H3BO3和B(OH)4-中B原子杂化轨道的类型都为sp2
C.H3BO3是三元弱酸
D.含1molH3BO3的晶体中含有3mol氢键
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。
(1)他们设计如下实验装置,请你参与探究,并回答问题:
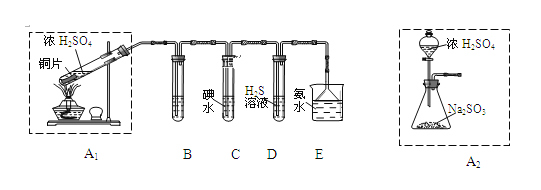
①装置A1中发生反应的化学方程式为_______;
②装置B用于检验SO2的漂白性,其中所盛试剂为_____,装置D用于检验SO2的_______性质;
③装置C中反应的离子方程式为_____;
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写一点即可)_____________________;
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体、实验在标准状况下测定)。
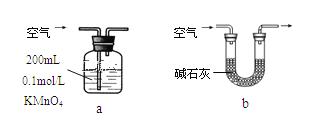
你认为哪个装置可行(填序号)______,使用你所选用的装置测定SO2含量时,还需要测定的物理量是_____________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列内容与结论相对应的是
选项 | 内容 | 结论 |
A | H2O(g)变成H2O(l) | △S>0 |
B | 硝酸铵溶于水可自发进行 | 因为△S>0 |
C | 一个反应的△H>0,△S>0 | 反应一定不自发进行 |
D | H2(g)+F2(g)=2HF(g),△H=-271kJ/mol △S=8J/(mol·K) | 反应在任意外界条件下均可自发进行 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究矿石样品A(仅含两种元素)的组成和性质,设计并完成如下实验:
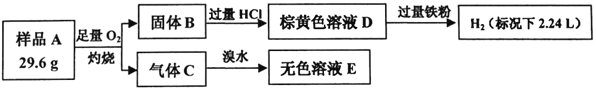
已知溶液D中只含一种金属阳离子,与铁粉充分反应后固体质量减少14 g。
请回答:
(1)样品A的化学式为________________。
(2)写出气体c与溴水反应的离子方程式___________________。
(3)写出样品A与盐酸发生氧化还原反应的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列热化学方程式正确的是( )
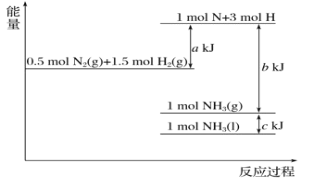
A.N2(g)+3H2(g)=2NH3(g) ΔH=-(b-a)kJ/mol
B.N2(g)+3H2(g)=2NH3(g) ΔH=-(a-b)kJ/mol
C.2NH3(l)=N2(g)+3H2(g) ΔH=2(b+c-a)kJ/mol
D.2NH3(l)=N2(g)+3H2(g) ΔH=2(a+b-c)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol某烃A在氧气中充分燃烧后,将产物依次通过浓硫酸和碱石灰,测得浓硫酸增重10.8g,碱石灰增重22g。请回答下列问题:
(1)烃A的分子式为__。
(2)写出其所有可能的结构简式并用系统命名法命名__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源
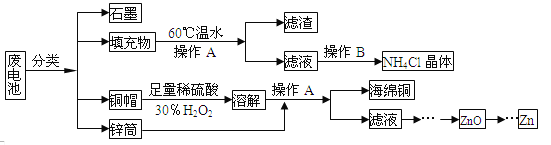
(1)填充物用60℃温水溶解,目的是__________。
(2)操作A的名称为____________。
(3)铜帽溶解时加入H2O2的目的是_______________________(用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为___________。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有_____mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥标出下列反应电子转移的方向和数目,并指出氧化剂、还原剂和氧化产物、还原产物。
①2KMnO4 + 16HCl=2KCl + 2MnCl2+ 5Cl2↑ + 8H2O_________。
氧化剂(___________)、还原剂(___________)、氧化产物(____________)、还原产物(____________)。
②H2S + H2SO4=S↓+ SO2↑+ 2H2O_______________。
氧化剂(___________)、还原剂(___________)、氧化产物(____________)、还原产物(____________)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A.CaCO3![]() CaO+CO2↑
CaO+CO2↑
B.CuO+CO![]() Cu+CO2
Cu+CO2
C.NaOH+HCl=H2O+NaCl
D.CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com