
(17分)由熔盐电解法获得的粗铝含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,
产生的尾气经处理后可用于钢材镀铝。工艺流程如下:
|
|
(注:NaCl熔点为801 ℃;AlCl3在181 ℃升华)
(1) 精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为:
① ________________________________________________________________________
② ________________________________________________________________________。
(2) 将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有_________;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在__________。
(3) 在用废碱液处理气体A的过程中,所发生反应的离子方程式为:_____________________________
__________________________________________________________________。
(4) 镀铝电解池中,金属铝为________极。熔融盐电镀液中铝元素和氯元素主要以AlCl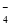 和Al2Cl
和Al2Cl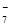 形式存在,铝电极的主要电极反应式为_____________________________________。
形式存在,铝电极的主要电极反应式为_____________________________________。
(5) 钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是_________________。
(1) Fe2O3+2Al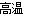 2Fe+Al2O3 (2分) 3SiO2+4Al
2Fe+Al2O3 (2分) 3SiO2+4Al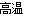 3Si+2Al2O3 (2分)
3Si+2Al2O3 (2分)
(2) HCl、AlCl3(1分) NaCl(1分)
(3) Cl2+2OH-===Cl-+ClO-+H2O (2分)、 H++OH-===H2O (2分)
(4) 阳(1分) Al+4Cl--3e-===AlCl (2分) 、 2Al+7Cl--6e-===Al2Cl
(2分) 、 2Al+7Cl--6e-===Al2Cl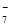 (2分)
(2分)
(5) 氧化铝膜能隔绝空气,阻碍钢铁被腐蚀(2分)
【解析】
试题分析:
(1) 坩埚表面的氧化铁和石英砂分别与铝发生置换反应:
Fe2O3+2Al 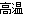 2Fe+Al2O3 3SiO2+4Al
2Fe+Al2O3 3SiO2+4Al 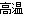 3Si+2Al2O3
3Si+2Al2O3
(2) 粗铝中含有H2,则与Cl2反应生成HCl,则气泡中含有HCl,同时Al与Cl2反应生成AlCl3,由于AlCl3在181 ℃升华,气泡中还含有AlCl3。有Na存在,其与Cl2反应生成NaCl,NaCl熔点高于700 ℃,存在于浮渣中。
(3) 尾气经冷凝后气体A含有Cl2和HCl,用碱液吸收的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O,OH-+H+===H2O。
(4) 在电镀池中,镀件作阴极,金属铝作阳极,铝电极的电极反应式为Al+4Cl--3e-===AlCl ,
,
2Al+7Cl--6e-===Al2Cl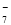 。
。
(5) 致密的氧化铝膜能防止钢材腐蚀是因为氧化铝膜能隔绝空气,阻止Fe与O2反应。
考点:考查电化原理等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:选择题
反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0)。下列示意图中,能正确表示总反应过程中能量变化的是

A B C D
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
下列物质的转化在给定条件下能实现的是
①NaAlO2(aq) AlCl3
AlCl3 Al ② NH3
Al ② NH3 NO
NO HNO3
HNO3
③NaCl(饱和) NaHCO3
NaHCO3 Na2CO3 ④FeS2
Na2CO3 ④FeS2 SO3
SO3 H2SO4
H2SO4
A.②③ B.①④ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:选择题
葛根素具有降血压等作用,其结构简式如下图,下列有关说法正确的是

A.该物质在一定条件下能发生消去反应、加成反应、取代反应
B.葛根素的分子式为C21H22O9
C.该物质一个分子中含有5个手性碳原子
D.一定条件下1 mol 该物质与H2反应最多能消耗7 mol H2
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:选择题
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示 对应的装置合理、操作规范的是
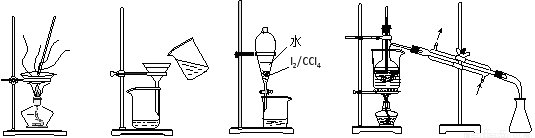
A.灼烧 B.过滤 C.分液D.蒸馏
查看答案和解析>>
科目:高中化学 来源:2015届广西桂林市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A、温度相同、体积相同的O2(g)和N2(g)分子数相同
B、等温等压下,SO2气体与CO2气体的密度之比等于16∶11
C、温度和容积相同的两气罐中分别盛有5mol O2(g)和2 mol N2(g),两容积中的压强之比等于5∶2
D、等温等压条件下, 5 molO2(g)和2 molH2 (g)的体积之比等于5∶2
查看答案和解析>>
科目:高中化学 来源:2015届广西桂林市高三上学期第一次月考化学试卷(解析版) 题型:选择题
有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。下列离子方程式中,只能表示一个化学反应的是
① Fe+Cu2+===Fe2++Cu ② Ba2++2OH-+2H++SO ===BaSO4↓+2H2O
===BaSO4↓+2H2O
③ Cl2+H2O===H++Cl-+HClO ④ CO +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
⑤ Ag++Cl-===AgCl↓
A、只有③ B、②③ C、③⑤ D、①④
查看答案和解析>>
科目:高中化学 来源:2015届广东肇庆中学高三8月考理综化学试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ都正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 非金属性:Cl>S | 酸性:HClO> H2SO3 |
B | SO2有氧化性 | SO2能使酸性KMnO4溶液褪色 |
C | NH3.H2O为一元弱碱 | 含有NH4+的水溶液均显弱碱性 |
D | 锌的金属性比铁强 | 海轮外壳上装锌块可减缓腐蚀 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第一次调研考试化学试卷(解析版) 题型:填空题
(16分) 碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g)  CO(g) +H2(g) ΔH= +131.3 kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g) +H2(g) ΔH= +131.3 kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
A.增加碳的用量 B.升高温度 C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+ CO2(g) 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1
则反应 CO(g)+H2O(g) CO2(g)+H2(g) 的△H= kJ?mol-1。
CO2(g)+H2(g) 的△H= kJ?mol-1。
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
t / min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
①其它条件不变,降低温度,达到新平衡前v(逆)_____v(正)(填“>”、“<”或“=”) 。
②该温度下,此反应的平衡常数K=______ _____;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com