
| A. | 硝酸在该反应中起酸性和氧化性作用 | |
| B. | 生成0.5molSe,转移电子数为2NA | |
| C. | I2是氧化产物 | |
| D. | 氧化剂和还原剂的物质的量之比为1:4 |
分析 SeO2+4KI+4HNO3═Se+2I2+4KNO3+2H2O中,Se元素的化合价降低,I元素的化合价升高,以此来解答.
解答 解:A.硝酸中N元素的化合价不变,则硝酸在该反应中起酸性作用,故A错误;
B.生成0.5molSe,转移电子数为0.5mol×(4-0)×NA=2NA,故B正确;
C.I失去电子被氧化,则I2是氧化产物,故C正确;
D.SeO2为氧化剂,KI为还原剂,由反应可知,氧化剂和还原剂的物质的量之比为1:4,故D正确;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意元素化合价的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
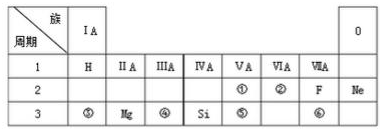
| A. | ①③⑤ | B. | ②④⑦ | C. | ②⑤⑧ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
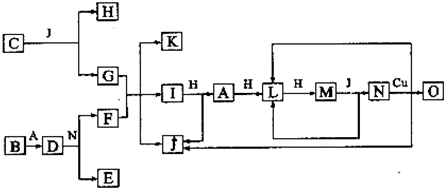
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强不随时间变化而变化 | |
| B. | 气体总物质的量不随时间变化而变化 | |
| C. | 2v正(B)=v逆(D) | |
| D. | 混合气体的密度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气 | |
| B. | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 | |
| C. | 滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3. | |
| D. | 钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
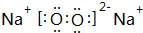
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4、H2O、O2 |
| ② | Cl2、FeBr2 | FeCl3、Br2 |
| ③ | KMnO4、HCl | Cl2、MnCl2 |
| A. | 第①组反应中,H2O2作还原剂 | |
| B. | 第②组反应中,Cl2与FeBr2的物质的量之比可能为3:2 | |
| C. | 第③组反应中,每生成1mol Cl2转移电子2mol | |
| D. | 从三个反应可以得出:氧化性由强到弱顺序为MnO4->Fe3+>Cl2>Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com