
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据下图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据下图回答下列问题: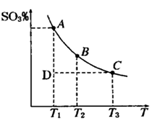
①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是 。
| A.体系的密度不发生变化 | B.SO2与SO3的体积比保持不变 |
| C.体系中硫元素的质量百分含量不再变化 | D.单位时间内转移4 mol 电子,同时消耗2 mol SO3 |
 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。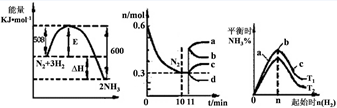
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:填空题
将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。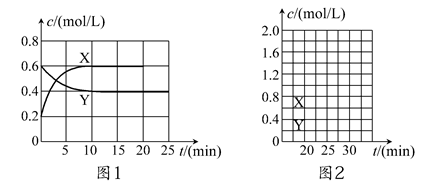
请回答:
(1)图l中,曲线________(填“X”或“Y”)表示NO2浓度随时间的变化情况;前10 min内v(NO2)=________mol/(L·min)。
(2)下列选项中不能说明该反应已达到平衡状态的是________(填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
10000C时,硫酸钠可与氢气发生反应:

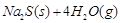 。请回答下列问题:
。请回答下列问题:
(1)上述反应的平衡常数表达式为: 。
(2)上述反应在三个不同条件下进行,其中H2的浓度随时间的变化如图所示。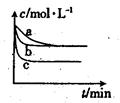
①与曲线a比较,b和c分别仅改变一种反应条件,则曲线b改变的条件为
②该反应的△H___0(填“>”、“<”或“=”),其判断理由是 。
(3)该温度下,向2L盛有1.42g Na2SO4的密闭容器中通入H2,5min后测得
固体质量为1.10g。则该时间范围内的平均反应速率v(H2)= 。
(4)能说明该反应已达到平衡状态的是 (填字母,下同)。
a.容器内压强保持不变
b.容器内气体密度保持不变
c.c(H2)=c(H2O)d.v正(H2)=v逆(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。汽车尾气中CO、NO2气体在一定条件下可以发生反应:4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH="-1" 200 kJ·mol-1
4CO2(g)+N2(g) ΔH="-1" 200 kJ·mol-1
(1)恒温恒容条件下,不能说明该反应已达到平衡状态的是 (填字母,下同)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2v(NO2)逆=v(N2)正
D.容器内混合气体密度保持不变
(2)能使该反应的反应速率增大,且平衡向逆反应方向移动的是 。
A.及时分离出CO2
B.适当升高温度
C.减小容器体积使体系压强增大
D.选择高效催化剂
(3)对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)反应②是 (填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。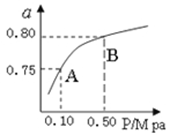
(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。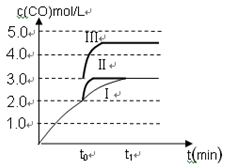
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
(4)甲醇燃料电池有着广泛的用途,同时Al-AgO电池是应用广泛的鱼雷电 池,其原理如图所示。该电池的负极反应式是 。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I2(g) WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
WI2(g) (I)。该反应在石英真空管中进行,如下图所示: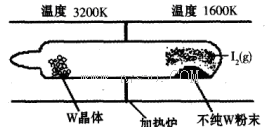
①反应(I)的平衡常数表达式K=_______,若K=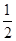 ,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
②反应(I)的△H____0(填“>”或“<”),上述反应体系中可循环使用的物质是_________。
③能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
(2)25℃时,NaHSO3的水解平衡常数=1.0×10-12mol/L,则该温度下H2SO3 HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中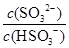 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)直接排放含SO2的烟气会形成酸雨,危害环境。用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-): n ( HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为:N2(g)+3H2 2NH3 △H=" -" 92.4kJ/mol
2NH3 △H=" -" 92.4kJ/mol
①将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
此温度下该反应的平衡常数K= 。
②欲提高H2的转化率,下列措施可行的是 。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g)  2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
①用O2表示从0~2s内该反应的平均速率v=___________。
②能说明该反应已经达到平衡状态的是_________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(3)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一定体积的密闭容器中,进行化学反应CO2 (g)+H2 (g) CO (g)+H2O (g),其化学平衡常数K和温度t的关系如下表:
CO (g)+H2O (g),其化学平衡常数K和温度t的关系如下表:
| t / ℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某恒容容器内发生的可逆反应的化学平衡常数表达式为: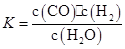 。能判断该反应一定达到化学平衡状态的依据是( )
。能判断该反应一定达到化学平衡状态的依据是( )
①容器中气体的平均相对分子质量不随时间而变化
②v正(H2O)=v逆(H2)
③容器中气体的密度不随时间而变化
④容器中气体总质量不随时间而变化
⑤消耗n mol H2的同时消耗n mol CO
| A.①②③ | B.①②③④ | C.② | D.①④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com