
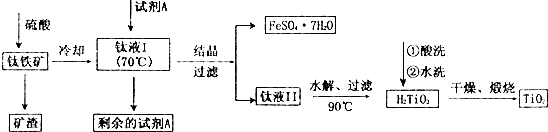
| A. | 过滤 | B. | 蒸发浓缩冷却结晶过滤 | ||
| C. | 水洗 | D. | 灼烧 |
科目:高中化学 来源: 题型:解答题
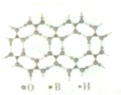 元素周期表可以指导我们寻找和合成成新的物质,如金属和非金属分界线附近的元素可用于制造半导体材料,是科学研究的热点
元素周期表可以指导我们寻找和合成成新的物质,如金属和非金属分界线附近的元素可用于制造半导体材料,是科学研究的热点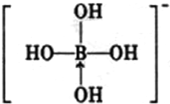 或
或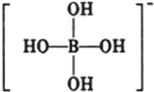 ,硼酸具有层状结构,每层结构如图所示,每摩尔晶体中所含氢键的数目为3NA(设NA为阿伏伽德罗常数的值)
,硼酸具有层状结构,每层结构如图所示,每摩尔晶体中所含氢键的数目为3NA(设NA为阿伏伽德罗常数的值)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
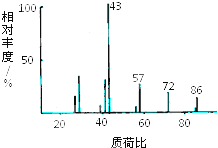 某有机物含有C、H、O三种元素,其质谱如图所示.将4.3g该有机物在O2中充分燃烧,使生成物依次通过足量浓硫酸和碱石灰,浓硫酸增重2.7g,碱石灰增重8.8g,则:
某有机物含有C、H、O三种元素,其质谱如图所示.将4.3g该有机物在O2中充分燃烧,使生成物依次通过足量浓硫酸和碱石灰,浓硫酸增重2.7g,碱石灰增重8.8g,则:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
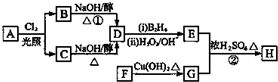
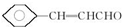 .
. ;
;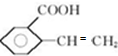 、
、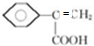 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(X2)=0.15 mol•L-1 | B. | c(Y2)=0.7 mol•L-1 | ||
| C. | c(Y2)=0.3 mol•L-1 | D. | c(Q2)=0.6 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
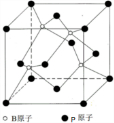
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
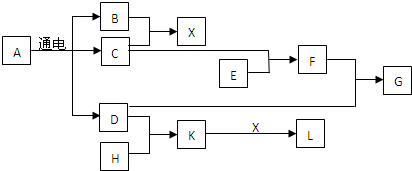
 ;HCl.
;HCl.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com