
| A. | 在pH=1的溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | |
| C. | 在0.1 mol•L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在$\frac{c({H}^{+})}{c(OH)}$=10-12的溶液中:K+、Na+、ClO-、NO3- |
分析 A.pH=1的溶液,显酸性;
B.离子之间相互促进水解;
C.离子之间结合生成络离子、氧化还原反应;
D.$\frac{c({H}^{+})}{c(OH)}$=10-12的溶液,显碱性.
解答 解:A.pH=1的溶液,显酸性,不能大量存在HCO3-,故A不选;
B.Al3+、CO32-相互促进水解,不能大量共存,故B不选;
C.Fe3+、SCN-结合生成络离子,Fe3+、I-发生氧化还原反应,不能共存,故C不选;
D.$\frac{c({H}^{+})}{c(OH)}$=10-12的溶液,显碱性,该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
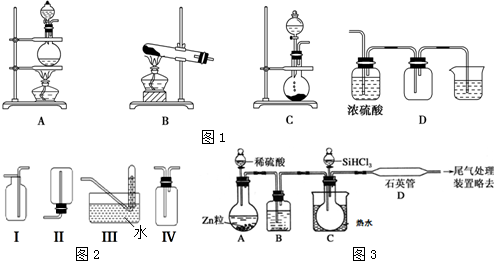
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸,应将水慢慢注入盛有浓硫酸的烧杯中并搅拌 | |
| B. | 酒精灯洒出的酒精万一在桌上着火,应立即用湿抹布扑盖 | |
| C. | 碱溶液沾到皮肤上,应尽快用抹布擦拭干净,再涂上稀盐酸 | |
| D. | 氢气还原氧化铜实验结束时,为节约氢气,应先停止氢气再停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
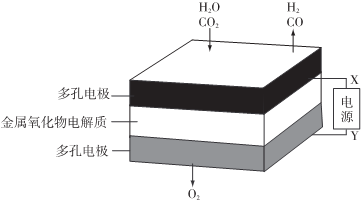
| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A>C>B>D | B. | 原子半径:B>D>C>A | ||
| C. | 原子序数:C>B>D>A | D. | 简单离子半径:D>B>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1的氨水中加入同体积的水 | |
| B. | 向0.1mol•L-1的KOH溶液中加入同体积的水 | |
| C. | 向0.2mol•L-1的氨水中加入同体积的0.1mol•L-1盐酸 | |
| D. | 向0.2mol•L-1的KOH溶液中加入同体积的0.1mol•L-1盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、OH-、Br- | B. | H+、Fe2+、SO42-、CO32- | ||
| C. | K+、NH4+、CO32-、OH- | D. | Ca2+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中既有物质变化又有能量变化 | |
| B. | 物质发生变化时,即使没有发生化学变化,也可能有能量的变化 | |
| C. | 任何化学反应中的能量变化都表现为放出热量或吸收热量 | |
| D. | 物质的化学能可以通过不同的变化方式转化为热能、电能等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com