
| 选项 | 物质 | 用途 | 解释 |
| A | H2O2 | 食品漂白剂 | H2O2具有强氧化性,能漂白食品 |
| B | SiO2 | 计算机芯片 | SiO2是一种良好的半导体 |
| C | Fe3O4 | 红色涂料 | Fe3O4是一种红色氧化物 |
| D | 浓H2SO4 | 干燥剂 | 浓H2SO4有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.H2O2具有强氧化性;
B.SiO2不是半导体;
C.Fe3O4是一种黑色氧化物;
D.脱水性是指浓硫酸可将许多有机化合物(尤其是糖类如纤维素、蔗糖等)脱水.反应时,按水分子中氢、氧原子数的比(2:1)夺取这些有机物分子里的氢原子和氧原子.
解答 解:A.H2O2具有强氧化性,可做漂白剂,故A正确;
B.晶体Si是半导体,能做计算机芯片,故B错误;
C.Fe3O4是一种黑色氧化物,不能用作涂料,用于红色涂料的是Fe2O3,故C错误;
D.浓硫酸能作干燥剂,利用的是浓硫酸的吸水性,故D错误.
故选A.
点评 本题主要考查了物质的用途,性质决定用途,用途体现性质,熟悉物质的性质即可解答,难度不大.


科目:高中化学 来源: 题型:解答题
 碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.
碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.| 难溶盐 | AgCl | AgBr | AgI | Ag2CrO4 |
| Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
| 颜色 | 白色 | 淡黄色 | 黄色 | 砖红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物 的名称为2-甲基-3,4-二乙基己烷 的名称为2-甲基-3,4-二乙基己烷 | |
| B. |  与 与 互为同系物 互为同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2A(l)+B(l)═2C(g);△H=+Q1 | B. | 2A(g)+B(g)═2C(g);△H=+Q2 | ||
| C. | 2A(g)+B(g)═2C(l);△H=+Q3 | D. | 2A(l)+B(l)═2C(l);△H=+Q4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
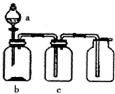 使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )
使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )| 选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 |
| A | 稀盐酸 | 铁粉 | H2O | 制备并收集H2 |
| B | 稀硫酸 | Na2SO3粉末 | 浓硫酸 | 制备并收集干燥的SO2 |
| C | 浓盐酸 | KmnO4粉末 | NaOH溶液 | 制备并收集Cl2 |
| D | 浓氨水 | 生石灰 | 碱石灰 | 制备并收集干燥的NH3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小 |
| B | 原子核外有三种不同的能量的原子轨道且各个轨道所填充的电子数相同 |
| C | 最外层p轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由X、Y、Z组成的化合物既能与强碱溶液反应,又能与强酸溶液反应 | |
| B. | W的氢化物水溶液是强酸 | |
| C. | Y元素的氢化物在同周期中是最稳定的 | |
| D. | 元素Y和W只能形成一种化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com