
| ①H2SO4溶液HSO4- | ②NaHSO4溶液HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
| a-0.01 |
| 2 |
| 0.01 |
| 2 |
10-7×
| ||
|


科目:高中化学 来源: 题型:
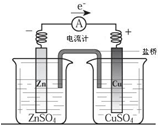 关于图所示装置(盐桥含KCl)的叙述,正确的是( )
关于图所示装置(盐桥含KCl)的叙述,正确的是( )| A、铜离子在铜片表面被氧化 |
| B、铜作阳极,铜片上有气泡产生 |
| C、电流从锌片经导线流向铜片 |
| D、如图烧杯中,SO42-的物质的量几乎不变,K+的数目增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为相互串联的甲、乙两电解池.试回答:
如图为相互串联的甲、乙两电解池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com