
| A. | 可以在空气中燃烧 | |
| B. | 与C12发生取代反应 | |
| C. | 可以与溴水中的溴反应而使溴水褪色 | |
| D. | 能使高锰酸钾溶液褪色 |
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁制管道涂铝粉可防锈蚀 | |
| B. | 碳酸钡、碳酸氢钠、氢氧化镁等均可作为抗酸药物使用 | |
| C. | 焊锡中加铅的目的是提高熔点 | |
| D. | 用废旧皮革生产药用胶囊可以提高原料利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与空气 | B. | 铝盐与氢氧化钠溶液 | ||
| C. | CO2通入石灰水 | D. | 过氧化钠与水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
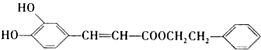 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化: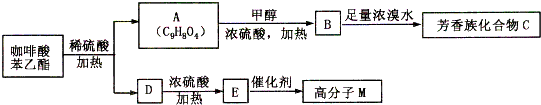
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
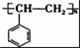
| A. |  | B. | 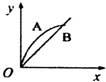 | C. | 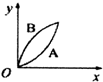 | D. | 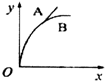 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
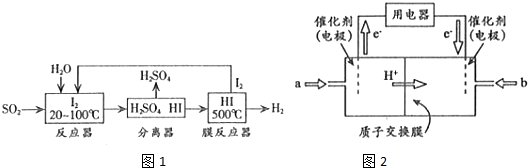
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
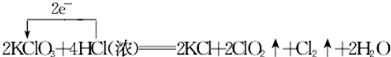 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇中含有的氧原子数目为NA | |
| B. | 6.4g的S2和S8混合物中,含硫原子总数为0.2NA | |
| C. | 0.1 mol•L-1的NaHSO4溶液中含有阳离子的总数为0.2NA | |
| D. | 7.8 g Na2O2与水反应,转移的电子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
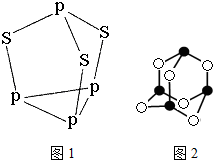 磷和砷元素形成的化合物在生活和生产中有重要的用途,回答下列问题.
磷和砷元素形成的化合物在生活和生产中有重要的用途,回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com