
【题目】下列反应中,属于取代反应的是()
A. 苯与浓硝酸、浓硫酸混合共热制取硝基苯
B. 在催化剂存在条件下乙烯与溴反应制1,2—二溴乙烷
C. 实验室利用乙醇制取乙烯
D. 在一定条件下苯与氢气反应制取环己烷
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】巴豆酸的结构简式为CH3—CH=CH—COOH。现有①氯化氢、②溴水、③纯碱溶液、④2丁醇、⑤酸性KMnO4溶液,试根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸反应的物质是( )
A. 只有②④⑤B. 只有①③④C. ①②③④⑤D. 只有①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸苯甲酯可提高花或果的芳香气味,常用于化妆品工业和食品工业,下图是乙酸苯甲酯的一种合成路线(部分反应物、产物和反应条件略去)。已知A是果实的催熟剂。

(1)A分子的电子式为________;C的分子式为________;D中官能团结构简式为________。
(2)A→B反应类型为_____________,反应F→G反应类型___________。
(3)G的同分异构体有多种,遇FeCl3溶液显紫色的共有_____种;
苯环上一氯代物有2种的物质的结构简式______________。
(4)写出下列反应的化学方程式:
B→C:_____________________;
F→G:______________________;
G→H:___________________;
C的银镜反应方程式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2C12是橡胶工业上常用的硫化剂,是一种金黄色液体。
已知:①S2C12不稳定,进一步氯化可得SCl2;②S2Cl2、SCl2都能与水反应, ![]() ==
== ![]() ==
==![]() ;③几种物质的熔沸点如表:
;③几种物质的熔沸点如表:

下图是实验室中通过向熔融的单质硫中通入少量氯气制取S2Cl2的装置(部分夹持、加热装置已略去)。

(1)B装置中仪器a的名称___________。
(2)装置的连接顺序是(每个装置只能使用一次)________________________________。
(3)装置D的作用是_________。
(4)实验开始时先点燃_______酒精灯再点燃 _______处酒精灯。
(5)由实验粗产品获得纯净的S2Cl2,需要进行的操作是_________,该操作的温度范围是___________。
(6)请设计实验证明所得产品中是否含有杂质SCl2_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. lmol苯乙烯中含碳碳双键数为4NA
B. 28g聚乙烯中含有的碳原子数目为2NA
C. 5.6g乙烯和环丁烷(C4H8)的混合气体完全燃烧需O2为1.2NA
D. 标准状况下,11.2L甲醇中含有的分子数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果汁中含有Fe2+,现榨的苹果汁在空气中会由浅绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有
A.氧化性 B.还原性 C.碱性 D.酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马日夫盐[Mn(H2PO4)2·2H2O]是一种白色晶体,易溶于水,常用于机械设备的磷化处理。以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和A l 2O3)为原料制备马日夫盐的流程如下:
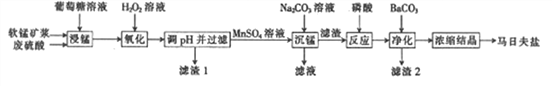
⑴软锰矿要先制成矿浆的目的是______________,葡萄糖(C4H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为___________________。
(2)用H2O2溶液“氧化”时发生反应的离子方程式为_______________________。
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表,“调pH并过滤”时,应调整的pH范围为______________,滤渣1的主要成分为____________(填化学式)。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为_____________________。
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9% ,则1吨该软锰矿可制得马日夫盐________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用。
(1)已知:3Fe2O3(s)+CO(g)=2Fe3O4(s)+4CO2(g) △H1=-47kJ/mol;
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H2=-14kJ/mol。
则Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=________。
(2)煤化工行业中常常通过研究不同温度下反应的平衡常数来解决各种实际问题。将等体积的CO和H2O(g)通入一恒容密闭容器中,发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示。
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
① 该反应的平衡常数表达式K=_______,该反应的正反应是_______(填“吸热”或“放热”)反应。
② 若反应在800℃时进行, CO和H2O(g)的起始浓度均为0.020 mol·L-1,则该条件下,CO的平衡转化率为_________。
③ 下列措施中能够提高CO转化率的是______(填字母)
a.降低温度 b.加入催化剂 c.增加CO的浓度 d.加入H2O(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com