
【题目】二氧化硫是造成大气污染的主要有害气体之一,二氧化硫尾气处理的方法之一是采用钠一钙联合处理法。
第一步:用NaOH溶液吸收SO2。2NaOH+SO2=Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应。Na2SO3+CaO+H2O=CaSO3↓+2NaOH
完成下列填空:
(1)在上述两步反应所涉及的短周期元素中,原子半径由小到大的顺序是_______(用元素符号填写)。
(2)氧和硫属于同族元素,写出一个能比较氧元素和硫元素非金属性强弱的化学反应方程式:_______________________________________。
(3)NaOH的电子式为______________ 。
(4)若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的化学方程式______________。
(5)钠一钙联合处理法的优点有________________。(任写一点即可)
【答案】H<O<S<Na2H2S+O2![]() 2S +2H2O
2S +2H2O![]() 2NaOH+Na2SO3+Br2 = Na2SO4+2NaBr+H2ONaOH吸收SO2的效率高;NaOH能循环利用;生石灰价格较低,成本低
2NaOH+Na2SO3+Br2 = Na2SO4+2NaBr+H2ONaOH吸收SO2的效率高;NaOH能循环利用;生石灰价格较低,成本低
【解析】
(1)两步反应所涉及的短周期元素中H、O、S、Na,原子半径由小到大的顺序是H<O<S<Na;(2)用氧置换硫;(3)NaOH是离子化合物;(4)溴将亚硫酸根离子氧化;
(1)两步反应所涉及的短周期元素中H、O、S、Na,H原子只有一个电子层,OS同主族,从上到下,原子半径变大,Na和S同一周期,从左到右变小,原子半径由小到大的顺序是H<O<S<Na;(2)比较氧元素和硫元素非金属性强弱的化学反应方程2H2S+O2![]() 2S +2H2O (3)NaOH的电子式为
2S +2H2O (3)NaOH的电子式为![]() ;(4)溴将亚硫酸根离子氧化: 2NaOH+Na2SO3+Br2 = Na2SO4+2NaBr+H2O;(5)钠一钙联合处理法的优点有NaOH吸收SO2的效率高;NaOH能循环利用;生石灰价格较低,成本低。
;(4)溴将亚硫酸根离子氧化: 2NaOH+Na2SO3+Br2 = Na2SO4+2NaBr+H2O;(5)钠一钙联合处理法的优点有NaOH吸收SO2的效率高;NaOH能循环利用;生石灰价格较低,成本低。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成(CH3)4NOH,其工作原理如下图所示(a、b为石墨电板,c、d、e为离子交换膜),下列说法正确的是( )

A. M为正极 B. c、e均为阳离子交换膜
C. b极电极反应式:2H2O-4e-=O2↑+4H+ D. 制备1mol(CH3)4NOH,a、b两极共产生0.5mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处有化学。请回答下列问题
(1)苏打水是很多人喜爱的饮品,请写出小苏打在水中的电离方程式__________
(2)“84消毒液”与洁厕灵(主要成分是浓盐酸)不能混用,混合会产生黄绿色的有毒气体,请用离子反应方程式解释原因____________
(3)咖啡中含有咖啡因(C8H10N4O2),咖啡因可以使我们的神经兴奋,若一杯咖啡中含有0.194g咖啡因,则这杯咖啡中有______________个咖啡因分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物提取物-香豆素,可用于消灭鼠害。其分子球棍模型如图所示。由C、H、0三种元素组成。下列有关叙述不正确的是( )
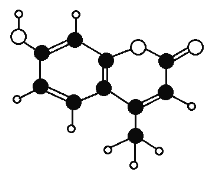
A. 该分了中不含手性碳原子
B. 分子式为C10H8O3
C. 能使酸性KMnO4溶液褪色
D. lmol香豆素最多消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性氧化锌用作橡胶硫化的活性剂、补强剂。以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如下:

一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
pH | 3.2 | 6.7 | 8.0 | 9.7 |
(1)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是_____________________________。
(2)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质。先加入___________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2,,经检测溶液中Fe2+的浓度为0.009mol·L-1,则每升溶液中至少应加入__________mol KMnO4。
(3)杂质Cu2+可利用置换反应除去,应选择的试剂是___________。
(4)“沉淀”后所得“滤渣”的成分为ZnCO3·2Zn(OH)2·H2O,其在450~500℃下进行“煅烧”,“煅烧”反应的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.01 mol·L-1两种弱酸溶液的pH如表,下列说法正确的是

A.相同pH的两种酸溶液中,CH3COOH溶液中水电离的c(H+)较大
B.物质的量浓度相同的CH3COONa与NaCN 溶液中,CH3COONa溶液pH较大
C.等体积pH相同的两种酸溶液,分别滴加NaOH溶液至恰好中和,消耗等量的NaOH
D.HCN的电离平衡常数(Ka)与CN—的水解平衡常数(K)存在如下关系:KaK=Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是
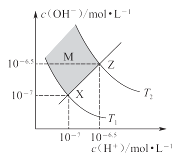
A. 两条曲线间任意点均有c(H+)·c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(以镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
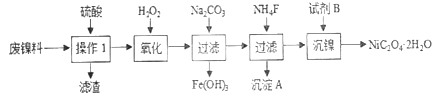
(1)操作1的名称为__________。
(2)保持其他条件相同,在不同温度下对废镍料进行“酸浸”,镍浸出率随时间变化如图。“酸浸”的适宜温度与时间分别为_______(填字母)。
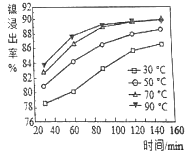
a.30℃、30min b.70℃、120min
c.90℃、150min d.90℃、120min
(3)沉淀A为CaF2和_________(填化学式)。
(4)试剂B的化学式为_________________。
(5)NiC2O4·2H2O样品经某稀酸酸化处理后,用稀KMnO4标准溶液滴定[在本实验条件下,Ni(Ⅱ)不能被氧化,其他物质不参与反应],通过测定草酸的量可测定NiC2O4·2H2O样品的纯度,滴定反应为:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O。实验中称取0.183g样品,滴定时消耗了0.0400mol.L-1的KMnO4溶液8.00mL,则该样品中NiC2O4·2H2O的质量分数为_________。
(6)高温煅烧草酸镍制取三氧化二镍时会产生CO、CO2、水蒸气等混合气体。某同学设计如下实验流程进行检验。
混合气体![]() 现象
现象![]() 现象
现象![]()
![]() 现象
现象![]() 现象
现象
①试剂1的名称为____________。
②证明混合气体有CO的现象是_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com