
【题目】碱式硫酸铝溶液可用于烟气脱硫。室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为
(2x)Al2(SO4)3+3xCaCO3+3xH2O![]() 2[(1x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
2[(1x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
生成物(1x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
(1)制备碱式硫酸铝溶液时,维持反应温度和反应时间不变,提高x值的方法有___________________。
(2)碱式硫酸铝溶液吸收SO2过程中,溶液的pH___________(填“增大”、“减小”、“不变”)。
(3)通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:
①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。
【答案】(12分)
(1)适当增加CaCO3的量或加快搅拌速率
(2)减小
(3)25mL溶液中:n(SO42)= n(BaSO4) =![]() =0.0100 mol
=0.0100 mol
2.5 mL溶液中:
n(Al3+) = n(EDTA)n(Cu2+)=0.1000 mol·L1×25.00 mL×103L·mL10.08000 mol·L1×20.00 mL
×103 L·mL1=9.000×104 mol
25 mL溶液中:n(Al3+)=9.000×103 mol
1 mol (1x)Al2(SO4)3·xAl(OH)3中
n(Al3+)=(2x)mol;n(SO42)=3(1x)mol
![]() x=0.41
x=0.41
【解析】分析:(1)提高x的值,即促进Al3+的水解和CaSO4的生成。
(2)碱式硫酸铝溶液吸收SO2,溶液碱性减弱,pH减小。
(3)根据加入过量BaCl2溶液产生的固体计算n(SO42-);由消耗的CuSO4计算过量的EDTA,由Al3+消耗的EDTA计算n(Al3+);根据n(Al3+)与n(SO42-)之比计算x的值。
详解:(1)制备碱式硫酸铝溶液,维持反应温度和反应时间不变,提高x的值,即促进Al3+的水解和CaSO4的生成,可以采取的方法是:适当增加CaCO3的量、加快搅拌速率。
(2)碱式硫酸铝溶液吸收SO2,溶液碱性减弱,pH减小。
(3)25mL溶液中:n(SO42-)= n(BaSO4)=![]() =0.0100 mol
=0.0100 mol
2.5 mL溶液中:n(Al3+) = n(EDTA)n(Cu2+)=0.1000 mol·L1×25.00 mL×103L·mL10.08000 mol·L1×20.00 mL×103 L·mL1=9.000×104 mol
25 mL溶液中:n(Al3+)=9.000×103 mol
1 mol (1-x)Al2(SO4)3·xAl(OH)3中n(Al3+)=(2-x)mol;n(SO42-)=3(1-x)mol
![]() =
=![]() =
=![]() ,解得x=0.41。
,解得x=0.41。


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存的无色透明离子组是( )
A. K+、Na+、CO32-、Cl- B. NH4+、Na 十、Br-、Cu2+
C. Mg2+、Na+、NO3-、SO42- D. Na十、Ba2+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,绘制出如下转化关系图。
![]()
请回答:
(1)若A为能使湿润的红色石蕊试纸变蓝的气体,C为红棕色气体。
①A、B、C、D中均含有的元素是_________________(填元素符号)
②A→B反应的化学方程式是________________________。
(2)若A为金属单质,C为淡黄色固体。
①A、B、C、D中均含有的元素是_________________(填元素符号)
②C→D反应的离子方程式是________________________。该反应中,发生氧化反应和还原反应的物质的物质的量之比为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应 NH3(g) +HCl(g)![]() NH4Cl(s)的 △H<0,△S<0
NH4Cl(s)的 △H<0,△S<0
B. 若在海轮外壳上附着一些钢块,则可以减缓海轮外壳的腐蚀
C. 用pH均为11的氨水和氢氧化钠溶液分别中和等体积、等浓度的盐酸,消耗氨水的体积大
D. H2O与Na2O2反应生成1 mol O2,反应中转移的电子数为4×6. 02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分生成物和反应条件已略去)。B的焰色反应呈黄色,C、D、E、G是常见的气体, C 、D、E是单质且C呈黄绿色;H与G的组成元素相同,H的摩尔质量为32g·mol-1,I是常见的盐类,J是紫红色金属单质。
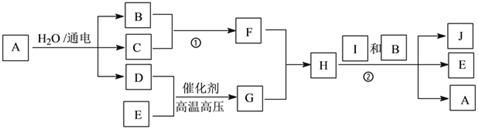
(1)D的化学式为_____________________。
(2)G的电子式为_____________________。
(3)写出反应①的离子方程式:_____________________。
(4)写出反应②的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( )
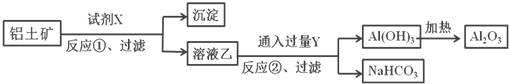
A. 反应①中试剂X是氢氧化钠溶液
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应中包含一个氧化还原反应
D. 将试剂X和Y进行对换,最终可以达到相同的效果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含 量过低,对实验的影响可忽略)。

已知:①NaClO溶液在受热或酸性条件下易分解,如: 3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
②AgCl可溶于氨水:AgCl+2NH3·H2O![]() Ag(NH3) 2++ Cl- +2H2O
Ag(NH3) 2++ Cl- +2H2O
③常温时 N2H4·H2O(水合肼)在碱性条件下能还原 Ag(NH3) 2+ :
4 Ag(NH3) 2++N2H4·H2O![]() 4Ag↓+ N2↑+ 4
4Ag↓+ N2↑+ 4![]() + 4NH3↑+H2O
+ 4NH3↑+H2O
(1)“氧化”阶段需在 80℃条件下进行,适宜的加热方式为__________________。
(2)NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2 ,该反应的化学方程式为_____________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是___________________。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并_______________________。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为___________________________。
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:________________________(实验中须使用的试剂有: 2 mol·L-1水合肼溶液,1 mol·L-1H2SO4 )。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com