


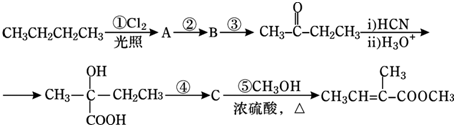
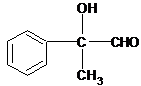 ,则C为
,则C为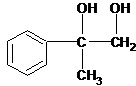 ,B为
,B为 ,则A为
,则A为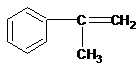 ,A与溴发生加成反应生成B,B发生水解(取代)反应生成C,C被氧化成D,由最终产物可知F为
,A与溴发生加成反应生成B,B发生水解(取代)反应生成C,C被氧化成D,由最终产物可知F为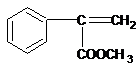 ,则E为
,则E为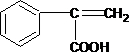 ,反应⑤为消去反应生成E,E再酯化(取代)生成F,F发生加聚反应得最终产物,结合有机物的结构和性质解答该题.
,反应⑤为消去反应生成E,E再酯化(取代)生成F,F发生加聚反应得最终产物,结合有机物的结构和性质解答该题.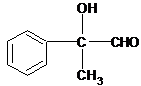 ,则C为
,则C为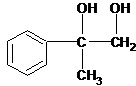 ,B为
,B为 ,则A为
,则A为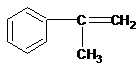 ,A与溴发生加成反应生成B,B发生水解(取代)反应生成C,C被氧化成D,由最终产物可知F为
,A与溴发生加成反应生成B,B发生水解(取代)反应生成C,C被氧化成D,由最终产物可知F为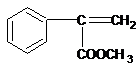 ,则E为
,则E为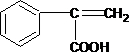 ,反应⑤为消去反应生成E,E再酯化(取代)生成F,F发生加聚反应得最终产物,
,反应⑤为消去反应生成E,E再酯化(取代)生成F,F发生加聚反应得最终产物,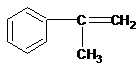 :B为
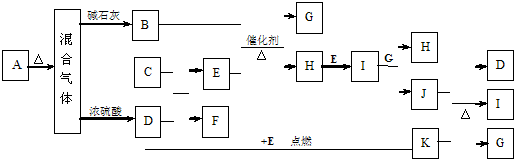
:B为 B在氢氧化钠的醇溶液中共热产物有2种,
B在氢氧化钠的醇溶液中共热产物有2种,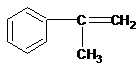 ;2;
;2;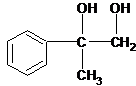 +O2
+O2| Cu |
| △ |
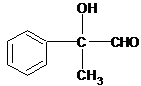 +2H2O,
+2H2O,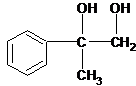 +O2
+O2| Cu |
| △ |
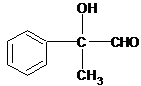 +2H2O;
+2H2O;  ①在浓硫酸的作用下,该有机物每2个分子间能形成一种环状酯,一个分子中的羧基与另一个分子中的羟基脱去水,2个分子之间脱去2分子水,所得酯的结构简式为
①在浓硫酸的作用下,该有机物每2个分子间能形成一种环状酯,一个分子中的羧基与另一个分子中的羟基脱去水,2个分子之间脱去2分子水,所得酯的结构简式为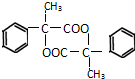 ,
, ;
;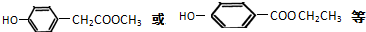 ,
,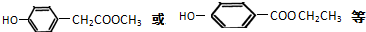 ;
;
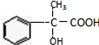 为突破口进行推断,注意官能团的变化和反应的条件.
为突破口进行推断,注意官能团的变化和反应的条件.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3???H++HCO3- HCO3-???H++CO32- | K1=4.31×10-4 K2=5.61×10-11 | |
| C6H5OH | C6H5OH???C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4???H++H2PO4- H2PO4-???H++HPO42- HPO42-???H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| NH3?H2O | NH3?H2O???NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4??Ba2++SO42- | 1.07×10-10 | |
| BaCO3 | BaCO3???Ba2++CO32- | 2.58×10-9 |
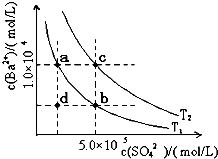 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠在空气中燃烧产生黄色火焰,生成淡黄色固体物质 |
| B、新制氯水呈浅黄绿色,氯水放置数天后pH将变大 |
| C、铁与稀盐酸反应生成氯化亚铁,而铁与氯气反应则生成三氯化铁 |
| D、漂白粉的有效成分是次氯酸钙,它具有漂白性是因为在水溶液中生成了有强氧化性的次氯酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com