
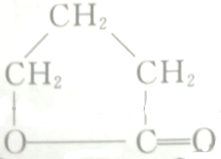
 的各步反应方程式:
的各步反应方程式: +H2O.
+H2O. 分析 制备 ,由逆合成法可知,需要HOCH2CH2CH2COOH,可由CH2ClCH2CH2CH2OH→CH2ClCH2CH2CHO→CH2ClCH2CH2COOH→HOCH2CH2CH2COOH→
,由逆合成法可知,需要HOCH2CH2CH2COOH,可由CH2ClCH2CH2CH2OH→CH2ClCH2CH2CHO→CH2ClCH2CH2COOH→HOCH2CH2CH2COOH→ 合成,以此来解答.
合成,以此来解答.
解答 解:合成流程为CH2ClCH2CH2CH2OH→CH2ClCH2CH2CHO→CH2ClCH2CH2COOH→HOCH2CH2CH2COOH→ ,发生的反应分别为
,发生的反应分别为
2CH2ClCH2CH2CH2OH+O2$→_{△}^{Cu}$2CH2ClCH2CH2CHO+2H2O、2CH2ClCH2CH2CHO+O2$→_{△}^{Cu}$2CH2ClCH2CH2COOH,
CH2ClCH2CH2COOH+2NaOH→HOCH2CH2CH2COONa+NaCl+H2O,
HOCH2CH2CH2COONa+HCl→HOCH2CH2CH2COOH+NaCl,
HOCH2CH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$ +H2O,
+H2O,
故答案为:2CH2ClCH2CH2CH2OH+O2$→_{△}^{Cu}$2CH2ClCH2CH2CHO+2H2O、2CH2ClCH2CH2CHO+O2$→_{△}^{Cu}$2CH2ClCH2CH2COOH;CH2ClCH2CH2COOH+2NaOH→HOCH2CH2CH2COONa+NaCl+H2O;HOCH2CH2CH2COONa+HCl→HOCH2CH2CH2COOH+NaCl;HOCH2CH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.
点评 本题考查有机物的合成,为高频考点,把握逆合成法及合成反应中官能团的变化为解答的关键,侧重分析与应用能力的综合考查,题目难度不大.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:解答题
 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(NO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 实验编号 | T/℃ | NO初始浓度/10-3mol•L-1 | CO初始浓度/10-3mol•L-1 | 催化剂的比表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
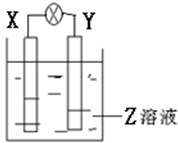 如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )| X | Y | Z | |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 锌 | 铜 | 硝酸银溶液 |
| D | 碳 | 锌 | 硝酸铜溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | X、Y、W三种元素的气态氢化物中,X的气态氢化物的水溶液碱性最强 | |
| B. | XW2的电子式为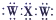 | |
| C. | 实验室制备YO2和WO2的发生装置都可用 | |
| D. | W和Y 的最高价氧化物对应的水化物的稀溶液溶解铁,表现出的性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层电子数是K层电子数的3倍 |
| Y | 第3周期元素的简单离子中半径最小 |
| Z | L层有5个电子 |
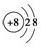 .写出元素Z的气态氢化物的化学式:NH3.
.写出元素Z的气态氢化物的化学式:NH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 样品中A的质量分数/% | 20 | 50 | 70 | 90 |
| 样品的质量损失/% | 7.4 | 18.5 | 25.9 | 33.3 |
| A. | 化合物A的摩尔质量为104g•mol-1 | |
| B. | 样品A的质量分数为55%,加热至400℃样品质量损失21.35% | |
| C. | 样品A加热后的气体能使品红褪色 | |
| D. | 16.8g化合物A加热至质量不变化后,剩余固体质量为10.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸和乙酸乙酯不能用饱和Na2CO3溶液鉴别 | |
| B. | 桶烯(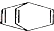 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 | |
| C. | 1.0mol的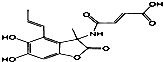 与NaOH溶液和H2反应时,分别需要消耗NaOH 6.0mol和H25.0mol 与NaOH溶液和H2反应时,分别需要消耗NaOH 6.0mol和H25.0mol | |
| D. | 按系统命名法,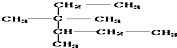 的名称为3,3-二甲基-2-乙基戊烷 的名称为3,3-二甲基-2-乙基戊烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com