
依据元素周期表及元素周期律,下列推断正确的是( )
|
| A. | 同一周期元素的原子,半径越小越容易失去电子 |
|
| B. | ⅠA族元素的金属性比ⅡA族元素的金属性强 |
|
| C. | 若M+和R2﹣的核外电子层结构相同,则原子序数:R>M |
|
| D. | 主族元素的最高正化合价等于该元素原子的最外层电子数 |
| 元素周期律和元素周期表的综合应用.. | |
| 专题: | 元素周期律与元素周期表专题. |
| 分析: | A.同一周期原子半径越小,原子核对电子的吸引越强,原子越容易获得电子; B.同周期ⅠA族元素的金属性比ⅡA族元素的金属性强; C.M+和R2﹣的核外电子层结构相同,M处于R的下一周期; D.主族元素的最高正化合价等于该元素原子的最外层电子数等于主族族序数. |
| 解答: | 解:A.同一周期原子半径越小,原子核对电子的吸引越强,原子越容易获得电子,故A错误; B.同周期ⅠA族元素的金属性比ⅡA族元素的金属性强,不同周期金属性不一定,如金属性Ca>Na,故B错误; C.M+和R2﹣的核外电子层结构相同,M处于R的下一周期,原子序数:M>R,故C错误; D.主族元素的最高正化合价等于该元素原子的最外层电子数,故D正确; 故选D. |
| 点评: | 本题考查结构性质位置关系,比较基础,注意基础知识的理解掌握. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:

请回答下列问题。
(1)流程甲加入盐酸后生成Al3+的离子方程式为____________。
(2)流程乙加入烧碱后生成SiO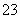 的离子方程式为___________。
的离子方程式为___________。
(3)验证滤液B含Fe3+, 可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是________(填化学式),写出该溶质的一种用途____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。主要步骤如下:
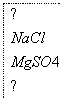
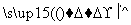
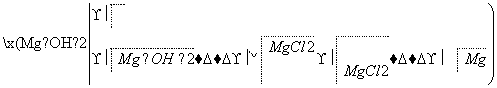
(1)为了使MgCl2转化为Mg(OH)2,试剂①可以选用________,要使MgCl2完全转化为沉淀,加入试剂①的量应________,验证MgCl2已完全转化为Mg(OH)2的方法是_____________________。
(2)加入试剂①,能够分离得到Mg(OH)2沉淀的方法是_____。
(3)试剂②可以选用________,反应的离子方程式为_______。
(4)无水MgCl2在熔融状态下,通电后会得到Mg和Cl2,写出该反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为________,原子个数比为________,分子的物质的量之比为________。
(2)等温等压下,等体积的O2和O3所含分子个数比为________,原子个数比为________,质量比为________。
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,那么c g氧气在标准状况下的体积约是________(用含NA的式子表示)。
(4)配制100 mL 1 mol·L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g·mL-1,质量分数为98%)的体积为_______mL。
(5)现要配制1 mol·L-1 Na2CO3溶液250 mL,求:①需要固体Na2CO3________g;②需要含结晶水的碳酸钠晶体(Na2CO3·10H2O)________g;③需要物质的量浓度为4mol·L-1的Na2CO3溶液________mL;④需要溶质的质量分数为12%、密度为1.12 g·cm-3的Na2CO3溶液________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
|
| A. | 稀硫酸不具有氧化性 |
|
| B. | NH4Cl中只含有离子键 |
|
| C. | 可用丁达尔效应区分溶液和胶体 |
|
| D. | 金属阳离子被还原时一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列装置能达到有关实验目的是( )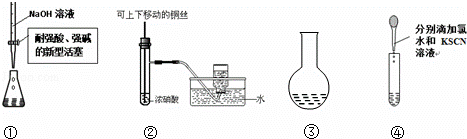
|
| A. | 用①量取15.00 mLNaOH溶液 |
|
| B. | 用②制备并收集少量NO2气体 |
|
| C. | 用③所示的仪器配制1L 0.1000mol/LNaCl溶液 |
|
| D. | 用④进行Fe2+的检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | NO | 紫色石蕊试液 | 溶液变红 | NO与水反应生成硝酸 |
| B | C2H4 | 溴水 | 溶液褪色 | 乙烯能与溴 发生加成反应 |
| C | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2有还原性 |
| D | NH3 | MgCl2溶液 | 产生白色沉淀 | NH3有碱性 |
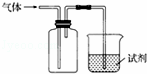
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,用铁棒和石墨棒作电极电解1 L 1 mol/L的食盐水,下列有关说法正确的是( )
A.电键K与N连接,铁棒被保护而免受腐蚀
B.电键K与N连接,正极反应式为4OH--4e-===2H2O+O2↑
C.电键K与M连接,当两极共产生标准状况下气体33.6 L时,理论上生成1 mol NaOH
D.电键K与M连接,将石墨棒换成铜棒,就可实现在铁棒上镀铜
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,以下各物质所含分子数最多的是
A.标准状况下11.2 L氯气 B.17g氨气
C.0. 8mol氧气 D.4℃时,36mL的H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com