
【题目】短周期主族元素M、X、Y、Z、W的原子序数依次增大,X和Z同主族,M和Z原子的最外层电子数均为各自所在周期数的2倍,Y的单质燃烧火焰呈黄色。下列推断正确的是
A. 简单离子的半径:Y<Z<W
B. 最简单氢化物的沸点:X<Z<W
C. 最高价氧化物对应水化物溶液的pH:W<Z<M
D. 化合物Y2M2中既有离子键也有共价键
【答案】D
【解析】“短周期原子最外层电子数为所在周期数的2倍”的包括C和S,则M为C元素,Z为S元素,则W只能是Cl元素;X和Z同主族,因此X为O元素;根据Y燃烧火焰为黄色判断Y为Na元素。A、Na+、S2-、Cl-离子中,Na+只有两个电子层半径最小,S2-、Cl-个有三个电子层半径比较大,而S、Cl的核电荷数分别为16、17,所以核电荷数较多的Cl-半径更小,正确顺序为S2->Cl->Na+,A错误。B、O、S、Cl的氢化物依次是H2O、H2S、HCl,都属于共价化合物,H2O分子间存在氢键所以沸点最高,而H2S的相对分子质量小于HCl,所以HCl沸点比H2S高,它们沸点的顺序为H2O>HCl>H2S,B错误。C、C、S、Cl的非金属性逐渐增强,所以最高价氧化物的水化物酸性逐渐增强,HClO4>H2SO4>H2CO3,但是由于溶液浓度未知,所以pH无法比较,C错误。D、化合物Y2M2为Na2C2,其结构为![]() ,因此既有离子键也有共价键,D正确。正确答案D。
,因此既有离子键也有共价键,D正确。正确答案D。


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】(题文)溶质的质量分数为14%的KOH溶液,经加热蒸发去100g水后,质量分数变成28%,体积为80mL,则此时溶液的物质的量浓度为
A. 5mol/L B. 6mol/L C. 6.25mol/L D. 6.75mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日本科学家发现一种可降解PET塑料的细菌,有望解决PET塑料带来的污染问题。PET朔料由甲、乙两种单体合成:
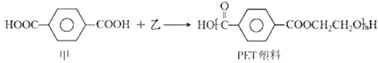
下列说法中,正确的是
A. 单体乙与乙醇互为同系物
B. PET的化学式为(C10H9O4)n
C. 1mol甲与Na2CO3反应最多生成CO21mol
D. 与甲互为同分异构体的芳香族化合物有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期律和元素周期表,下列推断不合理的是( )
A.第35号元素的单质在常温常压下是液体
B.第四周期第ⅤA族的元素为非金属元素
C.第二周期第ⅥA族的元素的最高化合价是+6
D.第七周期0族元素的原子序数为118
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是一种治疗脑血管疾病的常用药,它可以用烃A 为原料按以下路线合成:
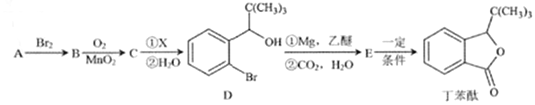
已知:I.A的质谱如下图所示;

II.C能发生银镜反应
III. 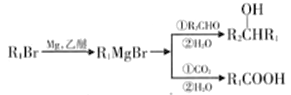
回答以下问题:
(1)A的名称是______________;丁苯酞所含官能团的名称是________________________。
(2)A→B的反应类型是________________;A→B的反应条件是___________________________。
(3)C的结构简式为________________________。
(4)E![]() 丁苯酞的反应方程式为_________________________。
丁苯酞的反应方程式为_________________________。
(5)芳香族化合物H与E所含官能团的种类和数目相同,H比E的相对分子质量小56.1mol H分别与NaOH溶液和NaHCO3溶液反应,消耗NaOH和NaHCO3的物质的量之比为2:1,则符合条件的H的结构有_____种;其中在核磁共振氡谱图中有5组吸收峰,峰面积之比为1:1:2:2:2的结构简式为_________________。
(6)参照题目信息,写出以![]() 为原料,制备
为原料,制备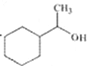 的合成路线(无机试剂及2个碳原子以内的有机试剂任选):____________________________________。
的合成路线(无机试剂及2个碳原子以内的有机试剂任选):____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正己烷、2甲基戊烷、( )、2,2二甲基丁烷、2,3二甲基丁烷。在上述有机物的有规律排列中,括号内填入的物质最适宜的是 ( )
A. 正戊烷 B. 2甲基丁烷
C. 3甲基戊烷 D. 2,2二甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1 ②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:____________。
(2)在一密闭容器中投入一定量的氨气,发生反应2NH3![]() N2+3H2△H>0,反应过程中NH3的浓度随时间变化的情况如图所示。
N2+3H2△H>0,反应过程中NH3的浓度随时间变化的情况如图所示。
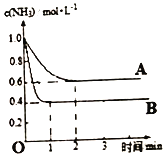
请回答:
①曲线A中,反应在前2min内氢气的平均反应速率为________。此条件下的平衡常数K=____。
②在其它条件相同时,若改变某一条件,使该反应发生如图曲线B的反应情况,则此条件可能是改变_________(填“浓度”、“压强”、“温度”或“催化剂”)。简述判断理由_________。
(3)一定温度下,在恒压密闭容器中N2O5可发生下列反应:
①2N2O5(g)![]() 4NO2(g)+O2(g) ②2NO2(g)
4NO2(g)+O2(g) ②2NO2(g)![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
若达平衡时,c(NO2)=0.6mol/L,c(O2)=1.2mol/L,则反应②中NO2的转化率为______,N2O5(g)的起始浓度应至少大于______mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com