
(2)58.5 g NaCl配成1 L溶液,其物质的量浓度为__________ mol·L-1。
(3)标准状况下,22.4 L HCl配成0.5 L盐酸,其物质的量浓度为__________ mol·L-1。
(4)2 mol NaOH配成200 mL溶液,其物质的量浓度为__________mol·L-1。
(5)物质的量浓度为2 mol·L-1 的硫酸溶液500 mL,含硫酸的物质的量为__________mol。
(6)10mol HCl能配成__________L物质的量浓度为2 mol·L-1的盐酸。
科目:高中化学 来源: 题型:
| 反应时间 | H2O | CO |
| 0 | 1.00 | 1.50 |
| t1 | 0.40 | |
| t2 | 0.90 |
| 0.3 |
| t1 |
| 0.3 |
| t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:


| 高温 |
| 选项 | 投料方式 |
| A | n(SiCl4):n(N2):n(H2)=1:1:2 |
| B | n(SiCl4):n(N2):n(H2)=1:2:2 |
| C | n(SiCl4):n(N2):n(H2)=3:2:2 |
| D | n(SiCl4):n(N2):n(H2)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源:101网校同步练习 高二化学 山东科学技术出版社 鲁教版 题型:022
取3.40 g只含羟基,不含其他官能团的液态饱和多元醇,置于5.00 L氧气中.点燃,醇完全燃烧.反应后气体体积减少0.56 L,将气体通过CaO进行吸收,体积又减少了2.80 L(所有气体体积均已换算成标准状况下的体积).
(1)3.40 g醇中C、H、O的物质的量分别为n(C)=________,n(H)=________,n(O)=________;分子中C、H、O的原子个数比为________.
(2)根据以上比值能否确定该醇的分子式?________.
原因:________.
(3)若将该醇的任意一个羟基换成氯原子,只得到一种氯代物,试写出该饱和多元醇的结构简式:________.
查看答案和解析>>
科目:高中化学 来源:2011届上海市松江区高三5月模拟测试化学试卷 题型:计算题
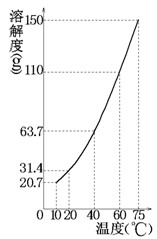
某固态混合物中含有mgKNO3和若干不溶于水的杂质,将此混合物加入ng水中,在10℃、40℃、75℃时观察,充分溶解后的结果如下(溶解度曲线如图所示):
| 温度 | 10℃ | 40℃ | 75℃ |
| 未溶固体 | 261 g | 175 g | 82 g |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省赣州市十二县高二上学期期中考试化学试卷(解析版) 题型:填空题
(1)在密闭容器中进行下列反应:M(g) + N(g) R(g) + 2L(?) ,此反应规律符合下图图像。
R(g) + 2L(?) ,此反应规律符合下图图像。

①T1 T2 ,正反应的△H 0。(填“>”、“<”或“=”,下同)。
②P1 P2 , L为 。(填“固”或“液”或“气”态)。
(2)合成氨的原理为:N2(g)+3H2(g)  2NH3(g)
2NH3(g)  H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。

①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。②若在一密闭容器中加入1molN2和3molH2,在一定条件下充分反应,放出的热量 92.4kJ.(填“>”、“<”或“=”)。
③将1 mol N2和3 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,此时欲提高该容器中H2的转化率,下列措施可行的是 (填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入一定量H2
C.改变反应的催化剂 D.液化生成物分离出氨
④若在密闭容器中充入2molN2和6molH2反应达平衡时N2的转化率为40%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率分别为 mol、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com