
| 实验 | 除杂试剂 | 实验目的 | |
| ① | CH3CH2Br与NaOH溶液共热 | HNO3溶液 | 用AgNO3溶液检验CH3CH2Br中的Br |
| ② | 淀粉与稀H2SO4水浴共热 | HNO3溶液 | 用银氨溶液检验水解产物的还原性 |
| ③ | C2H5OH与浓 H2SO4加热至170℃ | NaOH溶液 | 用KMnO4溶液证明该反应为消去反应 |
| ④ | 苯与液溴反应 | CCl4 | 用AgNO3溶液证明该反应为取代反应 |
| A. | ①②③④ | B. | 只有③④ | C. | 只有①②④ | D. | 只有①③④ |
分析 ①CH3CH2Br与NaOH溶液共热,发生水解反应;
②淀粉与稀H2SO4水浴共热,发生水解生成葡萄糖,检验葡萄糖应在碱性条件下;
③C2H5OH与浓H2SO4加热至170℃,发生消去反应生成乙烯,NaOH溶液可除杂,乙烯使高锰酸钾溶液褪色;
④苯与液溴反应,生成溴苯和HBr.
解答 解:①CH3CH2Br与NaOH溶液共热,发生水解反应,加硝酸至酸性,再利用硝酸银检验,实验合理,故正确;
②淀粉与稀H2SO4水浴共热,发生水解生成葡萄糖,检验葡萄糖应在碱性条件下,没有在碱性条件下,实验不合理,故错误;
③C2H5OH与浓H2SO4加热至170℃,发生消去反应生成乙烯,NaOH溶液可除杂,乙烯使高锰酸钾溶液褪色,实验合理,故正确;
④苯与液溴反应,生成溴苯和HBr,然后加四氯化碳发生萃取,对上层溶液加硝酸银生成浅黄色沉淀,实验合理,故正确;
故选D.
点评 本题以有机物的制备及实验考查物质的除杂、混合物的分离提纯,为高频考点,侧重有机物性质及实验原理的考查,综合性较强,水解产物的检验为解答的易错点,注意反应的条件,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2+HCl;Cu(OH)2+CH3COOH | B. | Na2CO3+H2SO4;Na2CO3+HCl | ||
| C. | CaCO3+H2SO4;CaCO3+HCl | D. | BaCl2+H2SO4;Ba(OH)2+H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨的pH在5.6~7.0之间 | B. | 向海水中加入明矾可以使海水淡化 | ||
| C. | 硅太阳能电池与原电池的原理相同 | D. | CO2和CH4均能引起温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
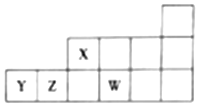
| A. | 原子半径:rW>rZ>rY>rX | |
| B. | 最高价氧化物对应水化物的酸性:Z>X>Y | |
| C. | X、Z、W形成的简单氢化物中X的氢化物沸点最高 | |
| D. | W与Y元素形成的化合物在水溶液中能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 | |
| B. | 维生素C具有较强还原性,高温烹饪蔬菜会导致维生素C损失 | |
| C. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| D. | 在食品包装袋中放入生石灰,可防止食物被氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2、MgO熔点高,可用于制作耐高温材料 | |
| B. | 天然气是可再生清洁能源,可用于工业制盐酸 | |
| C. | 硝酸铵属于氧化剂,严禁用可燃物(如纸袋)包装 | |
| D. | “一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称.丝绸的主要成分是蛋白质,属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,连接电源正极的电极方程式:Fe(OH)3-3e-+5OH-═FeO42+4H2O | |
| B. | 充电时,阴极附近溶液的pH增大 | |
| C. | 放电时,K+往正极移动 | |
| D. | 放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com