
| A | c(OH-)=1×10-13mol/L溶液中:Fe2+、NO3-、SO42-、Na+ | 不能共存 | 发生反应 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O |
| B | 溶液中:K+、Cu2+、Cl-、NH3?H2O | 不能共存 | 发生反应Cu2++2OH-=Cu(OH)2↓ |
| C | 常温常压下:NH3、O2、H2、CO2 | 不能共存 | NH3为碱性气体,CO2为酸性气体,二者反应生成(NH4)2CO3 |
| D | 溶液中:Al3+、Na+、SO42-、HCO3- | 可以共存 | 不能发生反应 |
| A、A | B、B | C、C | D、D |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、离子反应的活化能几乎为零 |
| B、发生有效碰撞的分子一定是活化分子 |
| C、活化能对化学反应的反应热会产生影响 |
| D、活化能指活化分子多出其它反应物分子的那部分能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、吃馒头时多咀嚼后有甜味 |
| B、淀粉溶液和稀硫酸共热一段时间后,滴加碘水不显蓝色 |
| C、葡萄糖被氧化成二氧化碳与水 |
| D、油脂与氢氧化钠溶液共煮后制肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、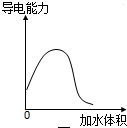 表示稀释冰醋酸过程中溶液导电性的变化曲线 |
B、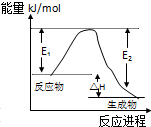 表示某一放热反应,若使用催化剂E1、E2,△H都会发生改变 |
C、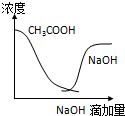 曲线表示将氢氧化钠滴加到醋酸溶液浓度的变化趋势 |
D、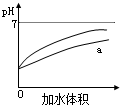 表示pH相同的盐酸与醋酸分别加入水中后溶液pH的变化,其中曲线a对应的是盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2发生还原反应 |
| B、NaClO3失去电子 |
| C、H2SO4作氧化剂 |
| D、1mol氧化剂得到1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com