
【题目】下列离子方程式书写正确的是
A. FeSO4酸性溶液中加H2O2溶液:Fe2++H2O2+2H+==Fe3++2H2O
B. 明矾溶液中加过量氢氧化钡溶液:Ba2++SO![]() == BaSO4↓
== BaSO4↓
C. 亚硫酸氢钠溶液中加氢氧化钠溶液:HSO![]() +OH-== SO
+OH-== SO![]() +H2O
+H2O
D. 稀硝酸加入碳酸银中有气泡产生:CO![]() +2H+==CO2↑+H2O
+2H+==CO2↑+H2O
科目:高中化学 来源: 题型:
【题目】氢气是重要的化学试剂、化工原料和有广阔发展前景的新能源。以甲醇为原料制备氢气的一种原理如下:
i.CH3OH(g) ![]() CO(g)+2H2 △H =+90kJ·mol-1
CO(g)+2H2 △H =+90kJ·mol-1
ii.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-41kJ·mol-1
CO2(g)+H2(g) △H =-41kJ·mol-1
(1)向VL恒容密闭容器中充入lmolCH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T)变化关系的曲线为_______________(填“A”或“B”),理由为_____________。T1℃时,体系的平衡压强与起始压强之比为_________________________。

(2)起始向10L恒容密闭容器中充入lmolCH3OH(g)和1molH2O(g),发生反应i利反应ii,体系中CO的平衡体积分数与温度(T)和压强(p)的关系如图2所示。
①随着温度升高,n(CO2)/n(CO)的值______(填“增大““减小”或“不变”),理由为____________。
②p1、p2、p3由大到小的顺序为___________________。
③测得C点时、休系中CO2的物质的量为0.2mol,则T2℃时,反应ii的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是制作电子集成电路的基础材料。用化学方法可制得高纯度硅,其化学方程式为:
①SiO2+2C![]() Si+2CO↑ ②Si+2Cl2
Si+2CO↑ ②Si+2Cl2![]() SiCl4
SiCl4
③SiCl4+2H2![]() Si+4HCl。
Si+4HCl。
下列对上述三个反应的叙述中,不正确的是
A. ①③为置换反应
B. ②为化合反应
C. ①②③均为氧化还原反应
D. 三个反应的反应物中硅元素均被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定呈酸性的是
A. pH<7的溶液 B. c(H+)>c(OH—) 的溶液
C. pH>7的溶液 D. c(H+)<c(OH—) 的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。用含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
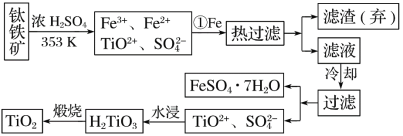
(1)步骤①加Fe的目的是________________________________________________________;步骤②冷却的目的是________________________________________________________。
(2)上述制备TiO2的过程中,可以利用的副产物是______________________。
(3)由金红石(TiO2)制取单质Ti,涉及到的步骤为TiO2―→TiCl4![]() Ti,反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是_________________________。
Ti,反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是在实验室进行二氧化硫制备与性质实验的组合装置,回到下列问题:
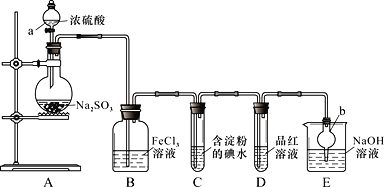
(1)仪器名称:a_____,b_____。装置A中制取SO2时不能用稀H2SO4代替浓H2SO4,原因是________________________。
(2)为了验证B中发生了氧化还原反应,应向B中加入下列试剂中的______(填序号)。
①KMnO4溶液 ②稀盐酸酸化的BaCl2溶液 ③NaOH溶液 ④KSCN溶液
能说明I-还原性弱于SO2的现象为________;发生反应的离子方程式是_______。
(3)要验证SO2与品红反应的产物不稳定,实验操作方法及现象是_______________。实验中的尾气用NaOH溶液吸收,反应的离子方程式是_______________。
(4)铜与浓硫酸在加热条件下反应也可制SO2,该反应体现了浓H2SO4的哪些性质?________,反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1molCl-,ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示,下列有关说法正确的是
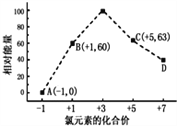
A. ClO2-→ClO3-+ClO4- 可以自发进行
B. A、B、C、D中C最稳定
C. B→A+D反应的活化能为60 kJmol-1
D. B→A+C反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq) △H= -117 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的无机化工产品之一,在国民经济中占有重要地位。我国采用铁触媒(以铁为主的混合物)做催化剂合成氨。回答下列问题:
(1)Fe基态原子核外电子排布式为____。氮化铁是一种重要的无机化合物,不溶于水,暴露在潮湿环境中可释放出氨气,元素Fe和N中,第一电离能较大的是_____,基态原子核外未成对电子数较多的是_______。
(2)N的氧化物有N2O等,N2O与CO2互为等电子体,N2O的空间构型为__________。
(3)N有多种氢化物,其中肼(N2H4)常用作火箭推进剂的燃料,N2H4中N原子的杂化形式为____。
(4)N、P、As为同族元素,NH3、PH3、AsH3三种物质的沸点由高到低的顺序为_____。原因是____。
(5)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中存在的化学键类型有_______。
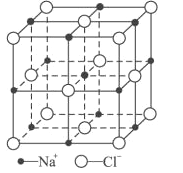
(6)FeO晶体的晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为428pm,则该晶体的密度为____g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com