
| A. | 1 mol H2完全燃烧生成气态水,放出241.8 kJ热量,H2的燃烧热△H=-241.8 kJ/mo1 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mo1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3kJ | |
| C. | 热化学方程式中,化学式前面的化学计量数可表示微粒数,不可表示物质的量 | |
| D. | 已知:C(金刚石,s)=C(石墨,s)△H<0,因此金刚石比石墨稳定 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量;
B.在稀溶液中,强酸和强碱反应生成1mol水放出的热量为中和热,中和热的单位是kJ/mol,但热量的单位是kJ;
C.热化学方程式中的计量数只表示物质的量,不表示微粒数;
D.物质具有的能量越低,物质越稳定.
解答 解:A.选项中生成的水是气体,应该是液态水,所以不能得出氢气的燃烧热是241.8 kJ/mol,故A错误;
B.已知H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mo1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,浓硫酸溶解过程会放出热量,则放出的热量大于57.3kJ,故B正确;
C.热化学方程式中,化学式前面的化学计量数不表示微粒数,只表示物质的量,故C错误;
D.已知C(石墨,s)=C(金刚石,s)△H>0,反应是吸热反应,石墨能量低于金刚石,能量越低越稳定,所以石墨比金刚石稳定,故D错误;
故选B.
点评 本题考查热化学方程式,题目难度中等,明确化学反应与能力变化的关系为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的分析能力及灵活应用基础知识的能力.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 密度:Li<Na<K<Rb<Cs | B. | 熔点、沸点:Li<Na<K<Rb<Cs | ||
| C. | 原子半径:Li<Na<K<Rb<Cs | D. | 氧化性:Li+<Na+<K+<Rb+<Cs+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
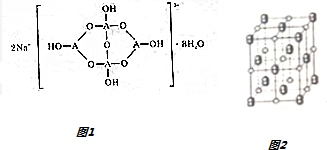

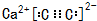 ,若晶胞的长、宽、高分别为520pm、520pm和690pm,则该晶体的密度为2.28g/cm3(精确至0.01)
,若晶胞的长、宽、高分别为520pm、520pm和690pm,则该晶体的密度为2.28g/cm3(精确至0.01)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
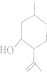 )是合成青蒿素的重要中间体,某小组设计合成M的路线之一如图所示(部分反应条件略去).
)是合成青蒿素的重要中间体,某小组设计合成M的路线之一如图所示(部分反应条件略去).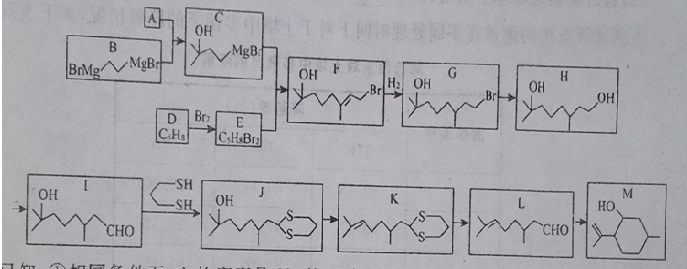
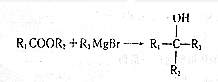
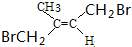 .
.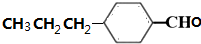 (写出其中任意一种的结构简式).
(写出其中任意一种的结构简式).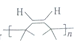 的合成路线2CH3COOCH3+BrMgCH2CH2MgBr→(CH3)C(OH)C(OH)(CH3)2$→_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)-C(CH3)=CH2$\stackrel{催化剂}{→}$
的合成路线2CH3COOCH3+BrMgCH2CH2MgBr→(CH3)C(OH)C(OH)(CH3)2$→_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)-C(CH3)=CH2$\stackrel{催化剂}{→}$ (无机试剂任选).
(无机试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将质量分数为40%(密度为1.43g•cm-3)的NaOH溶液与等体积水混合,所得溶液中溶质的质量分数是20% | |
| B. | 要配制浓度为0.25mol•L-1的NaOH溶液480mL,应称量4.8gNaOH在250mL的烧杯中溶解,冷却,再转移到500mL容量瓶中,洗涤、转移、定容 | |
| C. | 配制一定物质的量浓度的溶液,定容时俯视刻度线导致所配浓度偏高 | |
| D. | 配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com