
科目:高中化学 来源:不详 题型:单选题
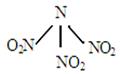
| A.分子中N、O原子间形成的共价键是非极性键 |
| B.分子中四个氮原子共平面 |
| C.该物质既有氧化性又有还原性 |
| D.分子中四个氮原子围成一个空间正四面体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.冰溶化时,分子中H—O键发生断裂 |
| B.在晶体中只要有阳离子,一定有阴离子 |
| C.离子化合物中可能含有非极性共价键 |
| D.在SiO2晶体中,Si原子与Si—O键数目比为1:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化硼液态时能导电而固态时不导电 | B.硼原子以sp杂化 |
| C.氯化硼遇水蒸气会产生白雾 | D.氯化硼分子属极性分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.[Cr(H2O)6] Cl3 | B.[Cr(H2O)5 Cl] Cl2·H2O |
| C.[Cr(H2O)4Cl2] Cl·2H2O | D.[Cr(H2O)3Cl3]·3H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,稳定性也越强 |
| B.以非极性键结合的分子,不一定是非极性分子 |
| C.判断A2B或AB2型分子是否是极性分子的依据是,具有极性键且分子构型不对称、键角小于180°的非直线型结构 |
| D.非极性分子中,各原子间都应以以非极性键结合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com