
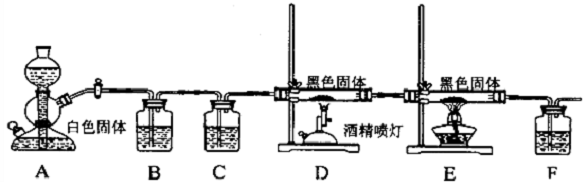
分析 装置A为气体发生装置,块状碳酸钙和稀盐酸反应生成二氧化碳气体,通过饱和碳酸氢钠溶液除去氯化氢气体,通过浓硫酸干燥二氧化碳气体,通过装置D中碳粉还原二氧化碳生成一氧化碳,通过装置E中的氧化铜氧化一氧化碳生成铜和二氧化碳,最后通过装置F检验二氧化碳的生成,碳和水蒸气加热反应生成一氧化碳和氢气,氢气具有还原性影响一氧化碳的验证,剩余一氧化碳可以收集或点燃处理,
(1)依据上述分析可知装置中的试剂分别为饱和碳酸氢钠、浓硫酸、碳、氧化铜、澄清石灰水;从实验结果的可靠性方面说明选择C中试剂是防止碳和水蒸气反应生成的氢气影响一氧化碳的检验;
(2)从实验安全角度考虑,在给D、E中的反应管加热之前需要利用生成的二氧化碳气体排净装置中的空气;
(3)D中反应为碳高温还原二氧化碳生成一氧化碳;
(4)E中黑色氧化铜变化为红色铜说明生成了一氧化碳;
(5)剩余一氧化碳有毒需要收集或点燃处理,不能排放到空气中;
(6)如果要通过F中的现象来证明CO的还原性,需要排除装置D中剩余的二氧化碳的干扰,需要除去二氧化碳,可以在DE间增加一个装有碱石灰的U形管除去.
解答 解:装置A为气体发生装置,块状碳酸钙和稀盐酸反应生成二氧化碳气体,通过饱和碳酸氢钠溶液除去氯化氢气体,通过浓硫酸干燥二氧化碳气体,通过装置D中碳粉还原二氧化碳生成一氧化碳,通过装置E中的氧化铜氧化一氧化碳生成铜和二氧化碳,最后通过装置F检验二氧化碳的生成,碳和水蒸气加热反应生成一氧化碳和氢气,氢气具有还原性影响一氧化碳的验证,剩余一氧化碳可以收集或点燃处理,
(1)上述分析可知BCDE中所选择的试剂为:饱和碳酸氢钠、浓硫酸、碳、氧化铜,所以选择c、a、i、j,从实验结果的可靠性方面说明选择C中试剂的理由是:避免H2O蒸汽与C反应生成H2,对CO的还原性验证产生干扰,
故答案为:c、a、i、j;避免H2O蒸汽与C反应生成H2,对CO的还原性验证产生干扰;
(2)从实验安全角度考虑,在给D、E中的反应管加热之前的一步实验操作是打开A中的活塞产生CO2排除装置中的空气,
故答案为:打开A中的活塞产生CO2排除装置中的空气;
(3)D中发生反应为碳高温还原二氧化碳生成一氧化碳,反应的化学方程式为:C+CO2 $\frac{\underline{\;\;△\;\;}}{\;}$2CO,
故答案为:C+CO2 $\frac{\underline{\;\;△\;\;}}{\;}$2CO;
(4)证明CO有还原性的实验现象是E反应管内黑色固体变为红色,
故答案为:E反应管内黑色固体变为红色;
(5)实验中的尾气是剩余的一氧化碳,用点燃(或者用气球收集)的方法处理,不能排放避免污染空气,
故答案为:点燃(或者用气球收集);
(6)如果要通过F中的现象来证明CO的还原性,需要排除装置D中剩余的二氧化碳的干扰,需要除去二氧化碳,可以在DE间增加一个装有碱石灰的U形管除去,
故答案为:D;E; k; U形管.
点评 本题考查了物质性质的实验验证、主要是干扰气体的除去和生成气体的实验验证,掌握基础是解题关键,题目难度中等.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:选择题
| A. | 漂白粉或漂粉精长期暴露在空气中会变质:Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO 2HClO=2 HCl+O2↑ | |
| B. | FeCl3溶液中加入铁粉,震荡后滴入几滴KSCN溶液,未见溶液变红:2Fe3++Fe═3 Fe2+ | |
| C. | 把水加入盛有过氧化钠固体的试管中,放出气体,可使带火星的木条复燃:2Na2O2+2 H2O═4 NaOH+O2↑ | |
| D. | 溶质物质的量之比为1:2的明矾溶液与 Ba(OH)2溶液混合,生成白色沉淀:Al3++2SO42-+2Ba2++4 OH-═2 BaSO4↓+Al(OH)3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
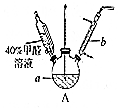 甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发.为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究.
甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发.为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究.
 $\stackrel{被氧化}{→}$
$\stackrel{被氧化}{→}$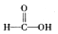 $\stackrel{被氧化}{→}$
$\stackrel{被氧化}{→}$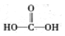 .设计实验证明a中甲醛的碳元素未被氧化成+4价.
.设计实验证明a中甲醛的碳元素未被氧化成+4价.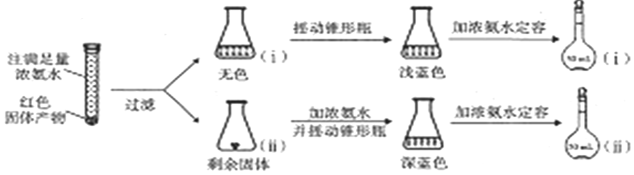
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
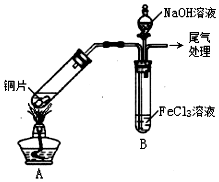 某化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去)
某化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第四周期第ⅢA族 | B. | 第四周期第ⅦA族 | C. | 第三周期第ⅣA族 | D. | 第三周期第ⅣB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醇不完全燃烧生成CO和液态水的热化学方程式:CH3OH(l)+O2 (g)═CO(g)+2H2O(l)△H1=-1009.5kJ•mol-1 | |
| B. | CH3OH(l)+$\frac{1}{2}$O2 (g)═CO2(g)+2H2 (g)△H1=-440.7kJ•mol-1 | |
| C. | 2H2O(g)═2H2(g)+O2(g)△H1=+571.6 kJ•mol-1 | |
| D. | 已知:S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2;则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由“C(s,石墨)-→C(s,金刚石)△H=+119 kJ•mol-1”可知金刚石比石墨稳定 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 | |
| C. | 在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 | |
| D. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) | |
| B. | 常温下,在pH=11的溶液中,水电离出的c(OH-)一定等于10-3mol/L | |
| C. | 若强酸、强碱中和后溶液的pH=7,则中和之前酸、碱的pH之和一定等于14 | |
| D. | 将物质的量浓度和体积都相同的一元酸HA与一元碱BOH混合后,溶液呈中性,则反应后溶液中c(H+)=$\sqrt{Kw}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com