
【题目】25 ℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A.25 ℃时,H2CO3的一级电离Ka1(H2CO3)=1.0×10-6.4
B.M点溶液中:c(H+)+ c(H2CO3)=c(Cl-) +2c(CO32-) +c(OH-)
C.25 ℃时,HC![]() +H2O
+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.图中a=2.6
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予研发锂离子电池的三位科学家。磷酸亚铁锂(![]() )常用于生产锂离子电池,请回答下列问题:
)常用于生产锂离子电池,请回答下列问题:
(1)![]() 中Li元素的化合价为______。
中Li元素的化合价为______。
(2)某锂离子电池放电时,![]() 以阳离子的形式脱离
以阳离子的形式脱离![]() 电极后,剩余的
电极后,剩余的![]() 本身会转变为一种电中性化合物,该化合物的化学式为____,放电过程中
本身会转变为一种电中性化合物,该化合物的化学式为____,放电过程中![]() ;发生了______(填“氧化”或“还原”)反应。
;发生了______(填“氧化”或“还原”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向恒温真空密闭容器中投入足量的FeC2O4(s),发生的反应为FeC2O4(s)![]() FeO(s)+CO(g)+ CO2(g) ΔH(制备FeO的原理),达到平衡时测得c(CO2)=c1 mol·L-1。温度不变,压缩容器体积至原来的一半,达到新平衡时测得c(CO2)=c2 mol·L-1。下列有关说法正确的是 ( )
FeO(s)+CO(g)+ CO2(g) ΔH(制备FeO的原理),达到平衡时测得c(CO2)=c1 mol·L-1。温度不变,压缩容器体积至原来的一半,达到新平衡时测得c(CO2)=c2 mol·L-1。下列有关说法正确的是 ( )
A.当混合气体中CO的体积分数保持不变时达到平衡状态
B.缩小容器体积,FeC2O4(s)、FeO(s)的物质的量保持不变
C.两次平衡体系中c1=c2
D.若温度不变,增大容器体积达到新平衡时,平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示。下列说法正确的是( )
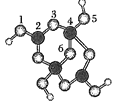
A.m=2
B.在Xm-中,硼原子轨道的杂化类型相同
C.1、2原子间和4、5原子间的化学键可能是配位键
D.若382g硼砂晶体中含2molNa+,则硼砂的化学式为Na2B4O710H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.向1 L 1 mol·L-1 NaClO溶液中通入足量CO2,溶液中HClO的分子数为NA
B.标准状况下,体积均为2.24 L的CH4与H2O含有的电子总数均为NA
C.2 mol NO与1 mol O2在密闭容器中充分反应,产物的分子数为2NA
D.由13 g乙酸与2 g CO(NH2)2(尿素)形成的混合物中含有的氢原子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化钼(MoO3)是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分
为MoS2)通过一定条件来制备。回答下列相关问题:
(1)已知:①MoS2(s)Mo(s)+S2(g) △H1;
②S2(g)+2O2(g)2SO2(g) △H2;
③2Mo(s)+3O2(g)2MoO3(s) △H3
则2MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) △H=______(用含△H1、△H2、△H3的代数式表示)。
(2)若在恒温恒容条件下仅发生反应MoS2(s)Mo(s)+S2(g)
①下列说法正确的是______(填字母)。
a.气体的密度不变,则反应一定达到了 平衡状态
b.气体的相对分子质量不变,反应不定处于 平衡状态
c.增加MoS2的量,平衡正向移动
②达到平衡时S2(g)的浓度为1.4 molL-1,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度______(填“>“<“或“=“)1.4 molL-1。
(3)在2L恒容密闭容器中充入1.0 molS2(g)和1.5 mol O2(g),若仅发生反应:S2(g)+2O2(g)2SO2(g),5 min后反应达到平衡,此时容器压强为起始时的80%,则0~5 min内,S2(g)的反应速率为______molL-1min-1。
(4)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) △H.测得氧气的平衡转化率与起始压强、温度的关系如图所示:
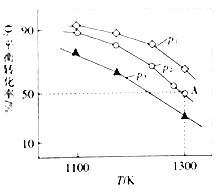
①△H______(填“>“*<“或“=“)0;比较p1、p2、p3的大小:______
②若初始时通入7.0molO2,p2为7.0 kPa,则A点平衡常数Kp=______(用气体平衡分压代替气体平衡浓度计算。分压=总压×气体的物质的量分数,写出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
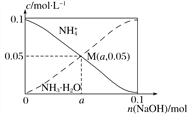
A. 在M点时,n(OH-)-n(H+)=(a-0.05) mol
B. 随着NaOH的加入,![]() 不断增大
不断增大
C. M点溶液中水的电离程度比原溶液小
D. 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用浓盐酸与浓硫酸混合快速制取HCl.下列解释合理的是( )
A.浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸
B.通过改变温度和浓度等条件,利用平衡移动原理制取HCl
C.两种强酸混合,溶解度会相互影响,低溶解度的物质析出
D.浓硫酸的浓度远大于浓盐酸的浓度,高浓度的酸制取低浓度的酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com