
| A、可用澄清石灰水鉴别这两种物质 |
| B、Na2CO3比NaHCO3更稳定 |
| C、相同条件下0.5 mol/L Na2CO3溶液碱性比NaHCO3强 |
| D、等物质的量的Na2CO3和NaHCO3与足量盐酸反应生成的二氧化碳质量相等 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 光照/叶绿素 |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①④ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 |
| B、金属钠着火时,立即用水灭火 |
| C、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| D、用托盘天平称取5.85 g NaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氯化钠溶于水发生电离,电离方程式为:NaCl
| ||||
| B、用过量氨水吸收烟道气中的SO2:SO2+2NH3?H2O═SO32-+2NH4++H2O | ||||
C、工业冶炼金属铝:AlCl3(熔融)
| ||||
| D、向物质的量之比为1:1的NaOH和Na2CO3混合物中加入过量稀盐酸:OH-+CO32-+2H+═HCO3-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
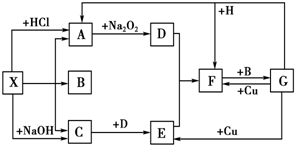
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com