
实验室用氯酸钾和二氧化锰制取氧气的反应方程式为: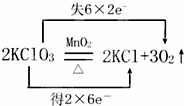 回答下列各题:
回答下列各题:
(1)该反应的基本类型为 .
(2)该反应中被还原的元素名称为 .
(3)式子“失6×2e﹣”中各数字的含义分别是 、 .
(4)从反应后的固体混合物中分离出难溶于水的MnO2操作方法:溶解、过滤、洗涤、干燥
(5)分离出的MnO2可用于实验室制取Cl2,化学方程式为MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O,其离子方程式为 ,反应中浓盐酸表现的性质是(填序号)BC
Cl2↑+MnCl2+2H2O,其离子方程式为 ,反应中浓盐酸表现的性质是(填序号)BC
A 氧化性 B还原性 C酸性
(6)以上两个反应都用到MnO2,其作用分别是 、 .
(7)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为.
考点: 氧化还原反应.
分析: (1)一种物质分解生成多种物质,属于分解反应;
(2)元素的化合价降低被还原;
(3)反应中6个氧原子失电子,每个失去2个电子;
(4)二氧化锰不溶于水,用过滤的方法分离;
(5)MnO2与浓盐酸反应生成氯气,HCl被氧化,同时生成盐氯化锰;
(6)氯酸钾和二氧化锰制取氧气时二氧化锰不参加反应,MnO2与浓盐酸反应生成氯气时二氧化锰中Mn元素的化合价降低;
(7)根据方程式分析计算.
解答: 解:(1)一种物质分解生成多种物质,属于分解反应,氯酸钾分解生成氯化钾和氧气属于分解反应;
故答案为:分解反应;
(2)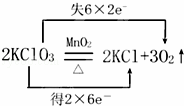 反应中,Cl元素的化合价从+5价降低到﹣1价,Cl元素的化合价降低被还原;故答案为:氯元素;
反应中,Cl元素的化合价从+5价降低到﹣1价,Cl元素的化合价降低被还原;故答案为:氯元素;
(3) 反应中O元素失电子,6个氧原子失电子12个电子,每个原子失去2个电子;
反应中O元素失电子,6个氧原子失电子12个电子,每个原子失去2个电子;
故答案为:6个氧原子;一个氧原子失去2个电子;
(4)氯酸钾和二氧化锰混合物加热,氯酸钾分解生成氯化钾,则反应后固体混合物为二氧化锰和氯化钾,加水溶解,二氧化锰不溶于水,然后过滤、洗涤、干燥,得到二氧化锰固体;
故答案为:溶解、过滤、洗涤、干燥;
(5)MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O中氧化物和单质写为分子形式,HCl和MnCl2拆为离子形式,其离子方程式为:MnO2+4H++2Cl﹣
Cl2↑+MnCl2+2H2O中氧化物和单质写为分子形式,HCl和MnCl2拆为离子形式,其离子方程式为:MnO2+4H++2Cl﹣ Mn2++Cl2↑+H2O,HCl中Cl元素的化合价升高被氧化,同时生成盐氯化锰,则HCl表现出还原性和酸性;
Mn2++Cl2↑+H2O,HCl中Cl元素的化合价升高被氧化,同时生成盐氯化锰,则HCl表现出还原性和酸性;
故答案为:MnO2+4H++2Cl﹣ Mn2++Cl2↑+H2O;BC;
Mn2++Cl2↑+H2O;BC;
(6)氯酸钾和二氧化锰制取氧气时二氧化锰不参加反应,二氧化锰作催化剂,MnO2与浓盐酸反应生成氯气时二氧化锰中Mn元素的化合价降低,二氧化锰作氧化剂;
故答案为:催化剂;氧化剂;
(7) 的反应中生成3mol氧气转移12mol电子,MnO2+4HCl(浓)
的反应中生成3mol氧气转移12mol电子,MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O反应中,生成1mol氯气转移2mol电子,则转移1mol电子时生成6mol氯气,所以转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为3:6=1:2;
Cl2↑+MnCl2+2H2O反应中,生成1mol氯气转移2mol电子,则转移1mol电子时生成6mol氯气,所以转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为3:6=1:2;
故答案为:1:2.
点评: 本题考查了氧化还原反应、物质分离的基本操作、离子方程式的书写、电子转移数的计算等,题目难度中等,侧重于基础知识的综合应用的考查,注意把握氧化还原反应中化合价的变化的分析判断.


科目:高中化学 来源: 题型:
在氧化还原化学反应中(2CuO+C 2Cu+CO2),物质所含元素化合价升高,这种物质是剂,在反应中 (“得”或“失”)电子;元素化合价降低,表明该元素的原子在反应中 (“得”或“失”)电子.
2Cu+CO2),物质所含元素化合价升高,这种物质是剂,在反应中 (“得”或“失”)电子;元素化合价降低,表明该元素的原子在反应中 (“得”或“失”)电子.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中水作氧化剂的是()
A. 2Na+2H2O═2NaOH+H2↑ B. 2F2+2H2O═4HF+O2↑
C. SO2+H2O═H2SO3 D. Cl2+H2O═HCl+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中物质的分类组合完全正确的是()
编号 A B C D
电解质 SO2 CaCO3 HClO NH3
非电解质 HF CS2 H2O C2H5OH
A. A B. B C. C D. .D
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中的Cl﹣浓度与50mL 1mol/L MgCl2溶液中的Cl﹣浓度相等的是()
A. 150 mL 1 mol/L NaCl溶液 B. 75 mL 2 mol/L CaCl2溶液
C. 150 mL 2 mol/L KCl溶液 D. 75 mL 1 mol/LAlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
实验中的下列操作正确的是()
A. 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,又把过量的试剂倒入试剂瓶中
B. Ba(NO3)2 溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道
C. 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干
D. 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后应冷却至室温再转移到容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分类正确的是()
碱 酸 盐 碱性氧化物 酸性氧化物
A Na2CO3 H2SO4 NaOH SO2 CO2
B NaOH HCl NH4Cl Na2O CO
C NH3•H2O CH3COOH NaCl Na2O2 SO2
D KOH HNO3 CaCO3 CaO SO2
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com