
【题目】向100 mL未知浓度的AlCl3和MgCl2的混合溶液中逐滴加入0.1 mol L-1的NaOH溶液,生成沉淀的质量随加入NaOH溶液体积的变化关系如图所示。则AlCl3的浓度为

A. 0.005mol L-1 B. 0.01mol·L-1
C. 0.2mol L-1 D. 0.1mol L-1
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
(1)升高温度,反应速率将_________,平衡将如何移动 ;
(2)加入正催化剂,反应速率将_________,平衡将如何移动 ;
(3)充入更多的H2,反应速率将_________,平衡将如何移动 ;
(4)扩大容器的体积,反应速率将_________,平衡将如何移动 ;
(5)容器体积不变,通入氖气,反应速率将___________,平衡将如何移动 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4![]() 2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
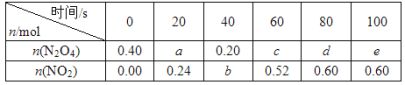
(1)计算20~40 s内用N2O4表示的平均反应速率为_________mol/( L s)。
(2)计算在80℃时该反应的平衡常数K=__________(请注明单位)。
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色______(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有_________(填序号)。
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
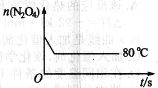
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含铅废料(主要含Pb、PbO、PbO2、PbSO4)和稀H2SO4为原料制备高纯Pb、PbO等,实现铅的再生利用。其主要流程如下:

(1)“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4,生成1mol PbSO4,转移电子的物质的量是________mol。Fe2+催化过程可表示为:
①2Fe2++PbO2+4H++SO42-=2Fe3++PbSO4+2H2O
②______________________。(用离子方程式表示反应②)
(2)写出脱硫过程发生主要反应的化学方程式:_______________________________。
(3)已知:①PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)==NaHPbO2(aq),其溶解度曲线如右图所示。

②粗品PbO中所含杂质不溶于NaOH溶液。结合上述信息,完成由粗品PbO得到高纯PbO的操作:将粗品PbO溶解在一定量______(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,_________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)将PbO粗品溶解在HC1和NaC1的混合溶液中,得到含Na2PbC14的电解液,电解Na2PbC14溶液,生成Pb,如右图所示。

①阴极的电极反应式是__________________________。
②电解一段时间后,Na2PbC14浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌、硫化锌都是重要的基础化工原料。
(1)ZnO 与 Al2O3 的化学性质相似,ZnO 在 NaOH 溶液中转化成[Zn(OH)4]2的离子方程式为_____________。
(2)火法炼锌得到的氧化锌中含有铅、铜等杂质,提纯步骤如下:
![]()
![]()
①上图中的“冷凝物”为________(填化学式)。

②某温度时,在反应Ⅰ的反应炉中,起始时 c(CO)为 0.3 molL1,反应过程中 CO2 的体积分数 φ(CO2)如图所示,则反应Ⅰ的平衡常数 K=_____。
③下列措施有利于提高反应Ⅰ中 ZnO 转化率的是________。
a.增大 ZnO 的投料量 b.适当加压 c.将锌蒸气及时分离
④反应Ⅱ中,每转移 1mol 电子,反应放热 174 kJ,则 H2=_____________。
(3)测定氧化锌样品纯度:称取 0.5000g 样品,酸溶后定容于 250 mL 容量瓶中,摇匀。量取 25.00 mL 该溶液,用 0.04000 molL1 的 EDTA(Na2H2Y)标准液滴定其中的 Zn2+(反应方程式为 Zn2++H2Y2=ZnY2+2H+,杂质不反应),平行滴定三次,平均消耗 EDTA 标准液 15.12mL。
①若滴定管未用 EDTA 标准液润洗,测定结果将___(填“偏高”、“偏低”或“不变”)。
②样品纯度为:________________(列出计算式即可)。
(4)彩电荧光屏中的蓝色荧光粉含有 ZnS。将含有 0.05mol ZnS 的荧光粉溶于 500mL盐酸中,完全溶解后,溶液中 c(S2)≤__________ molL1。(已知:Ksp(ZnS)=2.5×1023,忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuI是一种不溶于水的白色固体,它可以由反应2Cu2++4I-===2CuI↓+I2而得到。如图所示装置中,a、b都是惰性电极,通电一段时间后,在KI淀粉溶液中阳极周围变蓝色,则下列说法正确的是

A.若a极变红,则在Pt电极上:2I--2e-===I2,淀粉遇碘变蓝
B.若b极变红,则在Pt电极上:4OH--4e-===2H2O+O2↑,O2将I-氧化为I2,淀粉遇碘变蓝
C.若a极变红,则在Cu电极上:开始Cu+I--e-===CuI,一段时间后2I--2e-===I2,淀粉遇碘变蓝
D.若b极变红,则在Cu极上:Cu-2e-===Cu2+,Cu2+显蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B为气体单质,其中一种为黄绿色,二者反应生成气体C;D为常见金属单质,E溶液为浅绿色,它们之间有下列转化关系:

(1)写出C的溶液与D反应的离子方程式:___________。
(2)写出A通入E溶液生成F的离子方程式:___________。
(3)E溶液中含有F,除去F应加入试剂________,反应的离子反应方程式为:___________。
(4)检验F中的阳离子时,可加入试剂X的溶液,现象是:______________。X试剂的化学式是:___________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是有机合成的重要中间体,制备M的一种合成路线如下(部分反应条件和试剂已略去)

已知: ①A的密度是相同条件下H2密度的38倍;其分子的核磁共振氢谱中有3组峰;
②![]()
③![]()
请回答下列问题:
(1)B的化学名称为______________。A中官能团的电子式为________________。
(2)C中共面的原子最多有________个。I的结构简式为_____________________。
(3)F→G的化学方程式为________________________________________________。
(4)M不可能发生的反应为_______________(填选项字母)
A.加成反应 B.氧化反应 C.取代反应 D.消去反应
(5)同时满足下列条件的E的同分异构体有_________种。
①能与FeCl3溶液发生显色反应 ②能与NaHCO3反应 ③含有—个—NH2
(6)参照上述合成路线,以 ![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:_______________________________________________。
的合成路线:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离混合溶液中的AlCl3和FeCl2。

(1)沉淀A的化学式为________________ 。
(2)写出AlCl3溶液与过量NaOH溶液反应的离子方程式:___________________________。
(3)写出沉淀A转化为沉淀B反应的化学方程式:___________________。
(4)写出检验溶液A中是否含有Fe2+时的方法:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com