
| A. | 只被氧化 | B. | 被氧化与被还原的个数比为1:3 | ||
| C. | 只被还原 | D. | 氧化剂与还原剂的质量比是1:3 |
科目:高中化学 来源: 题型:解答题

| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
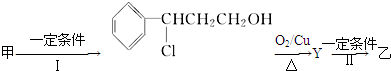
 (注明反应条件).
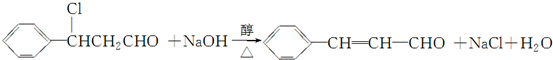
(注明反应条件).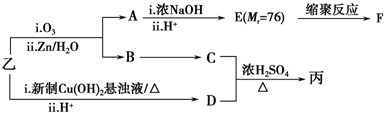
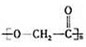 .
.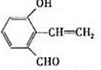 .
.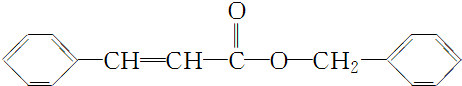 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1 | |
| B. | pH=2与pH=1的硝酸中c(H+)之比为1:10 | |
| C. | 在50℃时,pH=2的硫酸与pH=12的NaOH溶液等体积混合后,溶液的pH=7 | |
| D. | pH均等于5的HCl溶液和NH4Cl溶液中,水的电离程度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
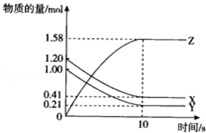 一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )
一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )| A. | 反应开始10s时,X的物质的量浓度减少了0.79mol•L-1 | |
| B. | 反应的化学方程式为:2X(g)+2Y(g)═3Z(g) | |
| C. | 反应开始到10s时,已用去的Y占起始量的百分比21% | |
| D. | 反应进行到10s时已达到了平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 观察颜色 | B. | 滴一滴硝酸在币的表面,观察现象 | ||
| C. | 用手掂量轻重 | D. | 查看图案 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com