

| A. | 实验Ⅰ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| B. | 实验Ⅱ:中和热测定 | |
| C. | 实验Ⅲ:可用来制取并收集NO2 | |
| D. | 实验Ⅳ:可用于HCl气体的吸收 |
分析 A.浓硫酸具有脱水性和氧化性,与蔗糖作用,生成二氧化硫气体;
B.温度计位置错误;
C.二氧化氮密度比空气大;
D.进气管较短,不能防止倒吸.
解答 解:A.浓硫酸与蔗糖反应生成二氧化硫气体,二氧化硫与酸性高锰酸钾发生氧化还原反应,故A正确;
B.温度计用于测量溶液的反应温度,应放在小烧杯中,故B错误;
C.二氧化氮密度比空气大,应用向上排空法,故C错误;
D.进气管较短,应插入烧瓶底部,否则不能防止倒吸,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高考常见题型,题目涉及性质的检验、气体的收集、中和热的测定等知识,注意把握物质的性质以及实验的严密性、可行性的评价,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol | B. | 0.4 mol | C. | 0.6 mol | D. | 0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
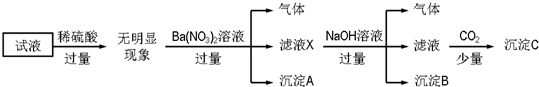
| A. | 沉淀A是BaSO4,说明原试液中一定含有SO42- | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+和Ba2+ | |
| C. | 沉淀C只有一种成分 | |
| D. | 原溶液中一定大量存在的离子只有:NH4+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.1mol/L氨水与0.1 mol/L稀盐酸等体积混合:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| B. | 将pH=2 的稀盐酸与pH=12的氨水等体积混合,所得溶液pH>7 | |
| C. | 0.10 mol•L-1的氨水用HNO3溶液完全中和后,溶液显中性 | |
| D. | 用惰性电极电解稀硫酸时,实质是电解水,溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质可以自由迁移,正极反应式为:MnO2+Li++e-=LiMnO2.回答下列问题:
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质可以自由迁移,正极反应式为:MnO2+Li++e-=LiMnO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 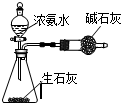 此图:制少量干燥的NH3 | |
| B. | 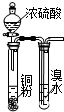 此图:验证浓硫酸具有强氧化性 | |
| C. | 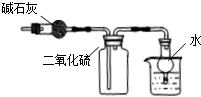 此图:干燥、收集并吸收多余SO2 | |
| D. | 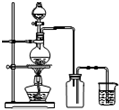 此图:实验室用MnO2和浓盐酸制取Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
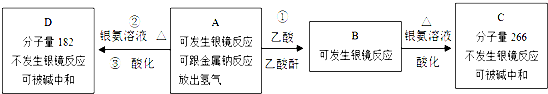
 、C
、C
 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$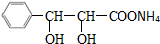 +3NH3+2Ag↓+H2O
+3NH3+2Ag↓+H2O (或
(或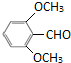 )
)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | b>a | C. | a=b | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com