
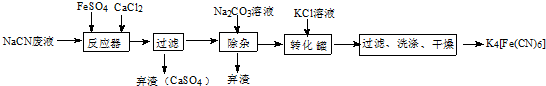
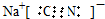 ;实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.
;实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.分析 氰化钠与硫酸亚铁,氯化钙反应,产生硫酸钙沉淀,过滤除去沉淀,滤液中存在主要离子有Na+、Cl-、Ca2+、[Fe(CN)6]4-,再加入碳酸钠溶液,除去多余的钙离子,再往滤液中加入KCl,此时溶液中出现沉淀,经过过滤,洗涤,干燥处理,得到K4[Fe(CN)6].
(1)电子式的书写,先要判断物质包含的化学键类型,化学键分为离子键与共价键.在盐溶液配制过程中常常要考虑盐的水解,NaCN是强碱弱酸盐,氰根离子水解溶液显碱性.用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.
(2)K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6],已知K4Fe(CN)6是可溶性盐,即K+、[Fe(CN)6]4-,Fe3+反应生成KFe[Fe(CN)6],根据电荷守恒,原子守恒写出离子反应方程式;
(3)观察流程图,发现前面加入CaCl2溶液,应加入Na2CO3.
(4)在相同温度下,溶液中含有大量的Na+、K+及[Fe(CN)6]4-,可以形成K4[Fe(CN)6]沉淀而没有形成Na4[Fe(CN)6]沉淀,根据溶解度定义作答.
(5)亚铁氰化钾会发生分解反应,知道反应物,生成物,根据质量守恒定律对化学反应方程式配平.
(6)离子反应方程式根据元素的原子守恒及电荷守恒的知识进行书写.
(7)该反应为氧化还原反应,高锰酸钾为氧化剂,黄血盐做还原剂,Fe的化合价+2→+3,C的化合价+2→+4,N元素的化合价-3→+5,Mn的化合价+7→+2,根据得失电子相等进行计算.
解答 解:(1)NaCN电子式的书写,氰化钠为离子化合物,钠离子与氰根离子形成离子键,碳元素与氮元素形成的共价键,形成共价键时碳氮都要形成8电子结构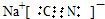 ;
;
NaCN是强碱弱酸盐,在溶液中溶液水解,使溶液显碱性.在实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于NaOH溶液,
故答案为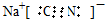 ; NaOH;
; NaOH;
(2)实验室K4Fe(CN)6可用于检验Fe3,检验Fe3+反应的离子方程式为K++[Fe(CN)6]4-+Fe3+=KFe[Fe(CN)6]↓;难溶盐KFe[Fe(CN)6可用于治疗Tl2SO4中毒,离子反应方程式为:KFe[Fe(CN)6](s)+Tl+(aq)=TlFe[Fe(CN)6](s)+K+(aq),
故答案为:K++[Fe(CN)6]4-+Fe3+=KFe[Fe(CN)6]↓; KFe[Fe(CN)6](s)+Tl+(aq)=TlFe[Fe(CN)6](s)+K+(aq);
(3)由于在前边加入了CaCl2溶液,在溶液中含有大量的Ca2+会影响制取物质的纯度,为了除去溶液中的Ca2+,要加入碳酸钠溶液一形成CaCO3沉淀除去,
故答案为:除去其中的Ca2+;
(4)在溶液中含有大量的Na+、K+及[Fe(CN)6]-,可以形成K4[Fe(CN)6]沉淀而没有形成Na4[Fe(CN)6]沉淀,说明在相同温度下溶解度:Na4[Fe(CN)6]>K4[Fe(CN)6,
故答案为:>;
(5)亚铁氰化钾会发生分解反应,根据原子守恒,电子守恒的知识,可得出方程式:3K4Fe(CN)6=Fe3C+12KCN+N2+C+2(CN)2↑,
故答案为:3K4Fe(CN)6=Fe3C+12KCN+N2+C+2(CN)2↑;
(6)电镀银时,电镀液不能直接用硝酸银溶液,可将其转变为K4[Ag2(CN)6],根据元素的原子守恒及电荷守恒的知识可得:AgCl与黄血盐制取电镀液的离子方程式是:2AgCl+[Fe(CN)6]4-=Fe2++[Ag2 (CN)6]4-+2Cl-
故答案为:2AgCl+[Fe(CN)6]4-=Fe2++[Ag2 (CN)6]4-+2Cl-;
(7)1mol K4Fe(CN)6 被高锰酸钾氧化时失去电子数为:(3-2)+(4-2)×6+【5-(-3)】×6=61mol,1mol KMnO4得到电子数为5mol,根据电子得失相等,消耗高锰酸钾的物质的量为$\frac{61}{5}$=12.2,
故答案为:12.2mol;
点评 本题考查学生对工艺流程的理解,阅读获取信息的能力,综合性较强,涉及电子式的书写,除杂问题,离子反应方程式,氧化还原反应的计算,题目难度中等.


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 得到沉淀的物质的量最大 | B. | 得到沉淀的质量最大 | ||
| C. | 反应后溶液仍含有Al3+ | D. | 反应后溶液仍含有AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.4 mol/( L•S ) | B. | v(C)=30 mol/( L•min ) | ||
| C. | v(B)=36 mol/( L•min ) | D. | v(A)=0.15 mol/( L•S ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因浓硫酸具有强氧化性,故不可用它来干燥氢气 | |
| B. | 浓硫酸不活泼,可用铁铝容器存放 | |
| C. | 浓硫酸有强氧化性,稀硫酸没有氧化性 | |
| D. | 浓硫酸难挥发,可用来制HF、HCl等挥发性酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,E是重要的建筑材料,F可用于清除铁锈.它们之间的转化关系如图所示(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).回答下列问题:
A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,E是重要的建筑材料,F可用于清除铁锈.它们之间的转化关系如图所示(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
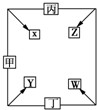 甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,其转化关系如图所示.又如:
甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,其转化关系如图所示.又如:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在25℃、1.01×105Pa的条件下,2.24 L H2中含有的分子数小于0.1NA | |
| B. | 1 L 1 mol•L-1的CaCl2溶液中含Cl-的数目为NA | |
| C. | 在标准状况下,22.4 L H2O的质量约为18 g | |
| D. | 22 g CO2与标准状况下11.2 L H2O含有相同的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,实现乙醇被氧化为乙醛的实验 | |
| B. | 相对分子质量相同的不同物质一定是同分异构体 | |
| C. | 淀粉和纤维素的分子式相同,所以两者互为同分异构体 | |
| D. | 可以用水鉴别硝基苯、乙醇、四氯化碳三种有机物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com