
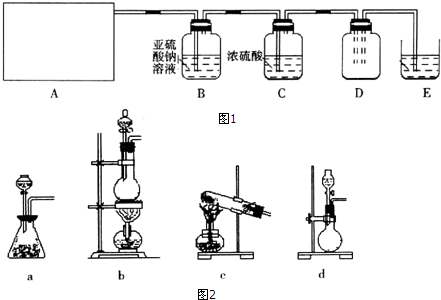
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量B中溶液于试管Ⅰ中,滴加过量稀盐酸和BaCl2溶液 | 若产生白色沉淀,则洗气瓶B溶液中存在SO42- |
| 步骤2:另取适量B中溶液于试管Ⅱ中,滴加过量Ba(NO3)2溶液,振荡,静置 | 产生白色沉淀 |
| 步骤3:取步骤2后试管Ⅱ中的上层清液于试管Ⅲ中,滴加稀HNO3和AgNO3溶液. | 若产生白色沉淀,则洗气瓶白溶液中存在Cl- |
分析 (1)实验室通常用二氧化锰与浓盐酸加热反应制备氯气,依据反应物状态和反应条件选择发生装置;
(2)氯气的密度大于空气的密度,应选择向上排空气法;
(3)氢氧化钠与氯气反应生成氯化钠、次氯酸钠和水;
(4)依据氯气与铜反应的条件解答;
(5)氯气具有强的氧化性,能够氧化亚硫酸根离子生成硫酸根离子,据此写出反应离子方程式;
检验硫酸根离子应排除亚硫酸根离子的干扰;检验氯离子选用硝酸银,反应生成氯化银不溶于稀硝酸.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,反应为固体+固体加热反应,应选择装置b;
故答案为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O; b;
(2)氯气的密度大于空气的密度,应选择向上排空气法,利用D中的广口瓶收集氯气,气体应长进短出,左边改为实线,
故答案为:左边改为实线;
(3)氢氧化钠与氯气反应生成氯化钠、次氯酸钠和水,反应离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯气与铜反应需要加热,所以应将铜丝在酒精烧至红热,
故答案为:在酒精烧至红热;
(5)亚硫酸根离子具有强的还原性能够被氯气氧化生成硫酸根离子,反应的离子方程式为:Cl2+SO32-+H2O═SO42-+2H++2Cl-;
检验洗气瓶B溶液中SO42-的存在,应排除亚硫酸根离子,先加入足量的稀盐酸,然后加入氯化钡溶液,若出现白色沉淀,即含有硫酸根离子;
检验氯离子存在,应排除硫酸根、亚硫酸根离子的干扰,取适量洗气瓶B中溶液于试管Ⅱ中,滴加 过量Ba(NO3)2溶液振荡,静置,取上层清液于试管Ⅲ中,滴加硝酸银和稀硝酸,若产生白色沉淀,则洗气瓶B溶液中存在Cl-;
故答案为:Cl2+SO32-+H2O═SO42-+2H++2Cl-;过量稀盐酸和BaCl2溶液;稀HNO3和AgNO3溶液.
点评 本题为实验题,考查了氯气的制备、氯气性质的检验,明确反应的原理,发生装置选择的依据是解题关键,注意硫酸根、氯离子的检验方法,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | 元素R的氧化物对应水化物一定为强酸 | |
| C. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 大理石放入稀硝酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 铝片插入浓烧碱溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 稀硫酸与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常采用电解法冶炼Y 单质 | |
| B. | 气态氢化物的稳定性:H2W强于H2Z | |
| C. | 离子半径由大到小:W2->X+>Y3+>Z2-? | |
| D. | W、X 形成的化合物中阴、阳离子个数比一定是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
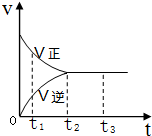 在一密闭容器中放入1mol X,进行可逆反应2X(g)?3Y(g),反应过程中的反应速率(v)与时间(t)的变化关系如图所示,下列叙述正确的是( )
在一密闭容器中放入1mol X,进行可逆反应2X(g)?3Y(g),反应过程中的反应速率(v)与时间(t)的变化关系如图所示,下列叙述正确的是( )| A. | t1时,只有正反应在进行 | |
| B. | t2~t3时间段,反应停止 | |
| C. | t2时,容器内有1.5mol Y | |
| D. | t2~t3时间段,X,Y的物质的量均没有发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | H-F | 565 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | C-F | 427 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
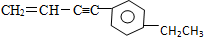 ,下列有关其结构的说法正确的是( )
,下列有关其结构的说法正确的是( )| A. | 所有碳原子可能在同一平面上 | B. | 最多有11个碳原子在同一平面上 | ||
| C. | 最多有5个碳原子在同一直线上 | D. | 最多有7个碳原子在同一直线上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com