
【题目】现有25mL 2molL﹣1 Na2CO3和75mL 1molL﹣1的稀盐酸:①将Na2CO3溶液缓缓滴到稀盐酸中 ②将稀盐酸缓缓滴到Na2CO3溶液中,在标准状况下产生气体的体积情况是( )
A.均为0.84 L
B.均为0.56 L
C.①>②
D.②>①
【答案】C
【解析】解:n(Na2CO3)=0.025L×2mol/L=0.05mol,n(HCl)=0.075L×1mol/L=0.075mol,
将Na2CO3溶液逐滴加入到盐酸中,有关反应为:Na2CO3+2HCl═2NaCl+CO2↑+H2O,
生成气体的体积为 ![]() ×0.075mol×22.4L/mol=0.84L,
×0.075mol×22.4L/mol=0.84L,
而将稀盐酸缓缓滴到Na2CO3溶液中,先发生Na2CO3+HCl═NaCl+NaHCO3 , 反应消耗0.05molHCl,剩余0.025molHCl,
盐酸过量时在发生NaHCO3+HCl═NaCl+CO2↑+H2O,则生成气体0.025mol×22.4L/mol=0.56L,
则①>②,
故选:C.
将Na2CO3溶液逐滴加入到盐酸中,有关反应为:Na2CO3+2HCl═2NaCl+CO2↑+H2O,而将稀盐酸缓缓滴到Na2CO3溶液中,先发生Na2CO3+HCl═NaCl+NaHCO3 , 盐酸过量时在发生NaHCO3+HCl═NaCl+CO2↑+H2O,结合物质的量的关系解答.


科目:高中化学 来源: 题型:
【题目】在反应3H2+N22NH3中,经一段时间后,氨的浓度增加了0.6mol/L,在此时间内用H2表示的平均反应速率为0.45mol/(Ls),则反应所经历的时间为( )
A.0.44 s
B.2 s
C.0.33 s
D.1 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背 , B元素位于周期表五个区域中的区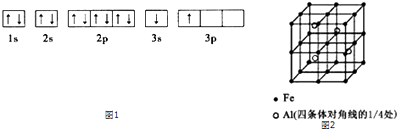
②ACl2分子中A的杂化类型为 , ACl2的空间构型为 .
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①以体心立方堆积形成的金属铁中,其原子的配位数为 .
②写出一种与CN﹣互为等电子体的单质的电子式 .
③六氰合亚铁离子[Fe(CN)6]4﹣中不存在 .
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(3)一种Al﹣Fe合金的立体晶胞如图2所示.请据此回答下列问题:
①确定该合金的化学式 .
②若晶体的密度=ρ g/cm3 , 则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为cm.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( ) 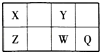
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的一部分如图,请参照元素①~⑨在表中的位置,用化学用语回答下列问题: 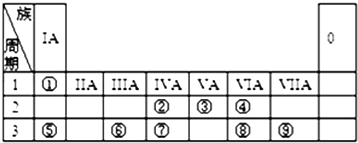
(1)已知②的一种核素中子数为8,则其气态氢化物的摩尔质量为
(2)①②⑤⑥的原子半径由大到小的顺序为(填元素符号);⑦⑧⑨的最高价含氧酸的酸性由强到弱的顺序是(填化学式): .
(3)⑥的最高价氧化物可以与⑤的最高价氧化物对应水化物的溶液能发生反应,该反应的化学方程式为:
(4)X、Y是中学化学中的常见物质,X、Y分别由元素④、⑤和②、④组成,X与Y的反应是潜水艇和呼吸面具中氧气的来源.X的电子式是 , Y中含有的化学键类型是 .
(5)某研究性学习小组设计了一组实验来探究元素周期律.甲同学设计了如图装置来一次性完成的②、⑦非金属性强弱比较的实验研究. 
甲同学设计实验的依据是;其中装置B中所盛试剂的作用为;C中反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如图1: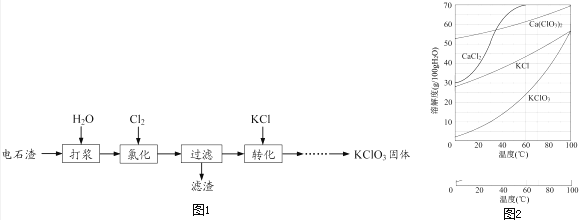
(1)氯化过程控制电石渣过量,在75℃左右进行.氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2 , 少量Ca(ClO)2 分解为CaCl2和O2 .
①生成Ca(ClO)2的化学方程式为 .
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有(填序号).
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为:
6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤.
①滤渣的主要成分为(填化学式).
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]:n[CaCl2]1:5(填“>”、“<”或“=”).
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3 , 若溶液中KClO3的含量为100gL﹣1 , 从该溶液中尽可能多地析出KClO3固体的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验填空题:实验室现要制取一瓶纯净干燥的氯气.现有如图仪器和药品可供使用: 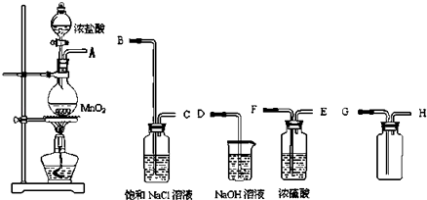
(1)实验室制取氯气的原理:;其中HCl所表现的性质是 .
(2)连接上述仪器的正确顺序是(填各接口处的字母)接 , 接 , 接 , 接 .
(3)在以上装置中,分别盛装了一些溶液,试说明所装溶液的作用.饱和食盐水的作用是;浓硫酸的作用是;氢氧化钠的作用是 .
(4)盛装NaOH溶液的试剂瓶中发生的化学反应为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个温度恒定且容积保持不变的容器中进行着如下反应:H2(g)+I2(g)2HI(g),能说明该反应已达到平衡状态的是( )
A.容器内 ![]()
B.容器内的压强不再变化
C.断裂1mol H﹣H的同时生成2mol H﹣I
D.容器内颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A元素原子的L层比B元素原子的L层少3个电子,B元素原子核外电子数比A元素原子核外电子总数多5个,则A,B两元素形成的化合物可表示为( )
A.BA2
B.BA3
C.A3B2
D.B3A2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com