
(15分)银氨溶液可用于检测CO气体,实验室研究的装置如图:
| 已知:银氨溶液制备反应为 Ag++2NH3·H2O=[Ag(NH3)2]++2H2O。 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用。 |
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的 (填“强氧化性”或“脱水性”)。
(2)装置A中软管的作用是 。
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
①实验c的目的是 。
②根据上述实验现象判断,上层清液中产物成分为 (填化学符号)。
(4)设计实验证明黑色固体的成分是Ag:
可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液。
取少量上述黑色固体,用蒸馏水洗净, ,说明黑色固体是Ag单质。(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①写出生成AgCl沉淀的离子反应 。
②若该反应中消耗6.6 g羟氨,理论上可得银的质量为 g。
(1)脱水性(1分) (2)恒压,使甲酸溶液能顺利滴下(2分)
(3)①对比试验,排除银氨溶液对产物检验的干扰(2分) ②(NH4)2CO3或NH4+、CO32—(2分)
(4)滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl 溶液,能产生白色沉淀,说明黑色固体为单质银。(4分)(试剂选对1个得1分,现象正确再得1分)
(5)①[Ag(NH3)2]++3H++Cl—=AgCl↓+2NH4+(2分) ②21.6(2分)
【解析】
试题分析:(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,反应中元素的化合价均没有发生变化,这说明浓硫酸均与脱水性。
(2)软管使分液漏斗与试管中的压强保持一致,则装置A中软管的作用是保持恒压,有利于使甲酸溶液能顺利滴下。
(3)a.测得上层清液pH为10,说明溶液显碱性。b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体,这说明溶液中含有铵根离子、碳酸根。c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象,这说明银氨溶液对产物检验没有干扰作用。
①根据以上分析可知实验c的目的是对比试验,排除银氨溶液对产物检验的干扰。
②根据上述实验现象判断,上层清液中产物成分为(NH4)2CO3或。
(4)因为只有浓硝酸才能溶解金属银,则证明黑色固体的成分是Ag的所以方案是 取少量上述黑色固体,用蒸馏水洗净,滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl 溶液,能产生白色沉淀,说明黑色固体为单质银。
(5)①银氨溶液与氯离子反应生成氯化银沉淀的离子方程式为[Ag(NH3)2]++3H++Cl—=AgCl↓+2NH4+。
②6.6 g羟氨的物质的量是6.6g÷33g/mol=0.2mol。羟氨被氧化为N2,氮元素化合价从—1价升高到0价失去1个电子,则共计失去0.2mol电子。银离子转化为金属银,得到1个电子,则根据电子得失守恒可知生成0.2mol银,质量是21.6。
考点:考查物质检验、性质实验方案设计与探究


科目:高中化学 来源:2014-2015吉林省松原市高一上学期期中化学试卷(解析版) 题型:选择题
下列各组离子中,在强碱性溶液中能共存,且在加入盐酸过程中会产生气体和沉淀的是
A. Na+、NO3-、AlO2-、SO42- B. Na+、Al3+、NO3-、SO42-
C. Na+、Mg2+、Cl-、HCO3- D. K+、Cl-、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省长沙市望城区高一上学期期末化学试卷(解析版) 题型:填空题
(6分)在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O的反应中, 是氧化剂,氧化产物是 ,此反应中,HCl表现的性质有酸性和______性。
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省长沙市望城区高一上学期期末化学试卷(解析版) 题型:选择题
化学概念在逻辑上存在如下图所示关系,对下列概念相互关系的说法中正确的是

A.纯净物与混合物属于包含关系
B.化合物与电解质属于包含关系
C.单质与化合物属于交叉关系
D.氧化还原反应与化合反应属于并列关系
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三1月月考理综化学试卷(解析版) 题型:选择题
稀土是工业味精,邓小平同志说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
A.电解熔融CeO2制Ce,铈在阳极获得
B.铈有四种稳定的核素 Ce、
Ce、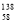 Ce、
Ce、 Ce、
Ce、 Ce,它们互为同素异形体
Ce,它们互为同素异形体
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+
D.由于氧化性:Ce4+>Fe3+,而I—有强还原性,所以铈溶于氢碘酸的化学方程式可表示为:2Ce+8HI=2CeI4+4H2↑。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三上学期期末考试化学试卷(解析版) 题型:填空题
(17分)二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)

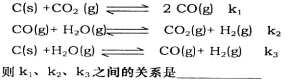
(2)已知在一定温度下,以下三个反应的平衡常数为k1、k2、k3:
(3)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池电解100mL 1mo1 的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的负极反应式为_____________。
②电解后溶液的PH=_________________________
(4)工业合成氨的反应为: mol-1
mol-1
已知合成氨反应在某温度下2L的密闭绝热容器中进行,测得数据如下表:

根据表中数据计算:
①0 min~1 min内N2的平均反应速率为_________
②该条件下反应的平衡常数k=________(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向_______(填“正向”、“逆向”或“不移动”),该反应的平衡常数k___________(填“变大”“减小”或“不变”)
(5)常温下,将0.2mol HCOOH和0.1mol
HCOOH和0.1mol NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。该溶液中[HCOOH]-[OH-]+[H+]=______mol
NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。该溶液中[HCOOH]-[OH-]+[H+]=______mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三上学期期末考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1mol氯气参加氧化还原反应,转移的电子数一定为2NA
B.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA
C.12 g石墨和C60的混合物中质子总数一定为6NA个
D.常温常压下,22.4L乙烯中C—H键数为4NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三1月月考化学试卷(解析版) 题型:选择题
下列有关物质性质的应用正确的是
A.浓硫酸有吸水性,可用于干燥氨气和二氧化硫
B.明矾溶于水能形成胶体,可用于自来水的杀菌消毒
C.常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
D.金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com