
下列各溶液中,相关微粒物质的量浓度关系不正确的是高
A.0.1 mol·L-1NH3•H2O溶液中: c (NH4+) < c (OH-)
B.0.1 mol·L-1 NH4Cl溶液中:c(NH4+)+c(H+)=c(Cl-)+c(OH-)
C.0.1 mol·L-1Na2CO3溶液中:c((HCO3-)+c(CO3-)+ c (H2CO3)= 0.1 mol·L-1
D.浓度均为0.1 mol·L-1的NH4Cl、CH3COONH4、NH4HSO4溶液,c(NH4+)大小顺序:CH3COONH4 > NH4Cl > NH4HSO4
科目:高中化学 来源:模拟题 题型:实验题
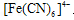 反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。结合新信息,请你设计以下实验验证猜想:
反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。结合新信息,请你设计以下实验验证猜想: 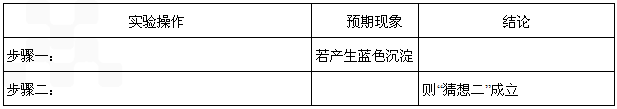
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com