
【题目】为测定某有机化合物A的结构,进行如下实验. 
(1)分子式的确定
将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2 , 消耗氧气6.72L(标准状况下).则该物质的实验式是;
(2)质谱仪测定有机物A的相对分子质量为46,则该物质的分子式;
(3)结构式的确定
预测A的可能结构并写出结构简式 .
(4)性质实验
核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:甲基氯甲基醚(Cl﹣CH2﹣O﹣CH3)有两种氢原子(见图甲).经测定,有机物A的核磁共振氢谱如图乙所示,则A的结构简式为 .
(5)A在一定条件下脱水可生成B,B可合成用于食品包装的塑料C,请分别写出转化反应化学方程式:
A→B:;
B→C: .
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式:
【答案】
(1)C2H6O
(2)C2H6O
(3)CH3CH2OH或CH3OCH3
(4)CH3CH2OH
(5)CH3CH2OH ![]() CH2=CH2↑+H2O;nCH2=CH2
CH2=CH2↑+H2O;nCH2=CH2 ![]()
![]()
(6)nCH2=CH2 +HCl ![]() CH3CH2 Cl
CH3CH2 Cl
【解析】解:(1)由题意可知n(H2O)= ![]() =0.3mol,n(CO2)=
=0.3mol,n(CO2)= ![]() =0.2mol,n(O2)=
=0.2mol,n(O2)= ![]() =0.3mol,
=0.3mol,
根据氧原子守恒可知有机物中含有n(O)=0.3mol+0.2mol×2﹣0.3mol×2=0.1mol,
则有机物中N(C):N(H):N(O)=0.2mol:0.6mol:0.1mol=2:6:1,则实验式为C2H6O,
所以答案是:C2H6O;(2)该物质中各元素的原子个数比为N(C):N(H):N(O)=2:6:1,则最简式为C2H6O,其相对分子质量为46,则有机物的分子式为C2H6O,
所以答案是:C2H6O;(3)有机物的分子式为C2H6O,分子中可能存在C﹣C、C﹣H、C﹣O、O﹣H等化学键,可能的结构简式有CH3CH2OH或CH3OCH3 ,
所以答案是:CH3CH2OH或CH3OCH3 . (4)有机物A分子中有三种不同化学环境的氢原子,应为乙醇,即CH3CH2OH,二甲醚只有一种不同化学环境的氢原子,
所以答案是:CH3CH2OH;(5)乙醇在一定条件下脱水可生成B,B为CH2=CH2 , B可合成包装塑料C,C为聚乙烯,反应的化学方程式分别为CH3CH2OH ![]() CH2=CH2↑+H2O、nCH2=CH2
CH2=CH2↑+H2O、nCH2=CH2 ![]()
![]() ,
,
所以答案是:CH3CH2OH ![]() CH2=CH2↑+H2O;nCH2=CH2
CH2=CH2↑+H2O;nCH2=CH2 ![]()
![]() ;(6)原子利用率为100%,可用乙烯与HCl加成方法制备,反应的方程式为nCH2=CH2 +HCl
;(6)原子利用率为100%,可用乙烯与HCl加成方法制备,反应的方程式为nCH2=CH2 +HCl ![]() CH3CH2 Cl,
CH3CH2 Cl,
所以答案是:nCH2=CH2 +HCl ![]() CH3CH2 Cl.
CH3CH2 Cl.
【考点精析】本题主要考查了有机物的结构和性质的相关知识点,需要掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:
(1)添加Cu2O的涂料或玻璃显色.
(2)制备氧化亚铜的方法之一是用铜作阳极电解NaCl和NaOH混合溶液,其原理如图所示: 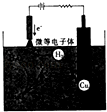
①阴极的电极反应式为 .
②溶液中CuCln1﹣n转化为Cu2O的离子方程式为
(3)工业生产中常采用高温煅烧氧化铜粉末制备Cu2O,但所得产品中会含有一定量CuO,测定产品中Cu2O的含量常用滴定法,其原理为: 样品溶解:Cu2O+Fe2(SO4)3+H2SO4═2FeSO4+2CuSO4+H2O.
滴定(未配平):□FeSO4+□KMnO4+□H2SO4═□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
①配平滴定反应的化学方程式.
②滴定时,KMnO4溶液盛放在(填“酸式”或“碱式”)滴定管中.
③若产品质量为1.0g,滴定时消耗0.10molL﹣1的KMnO4标准溶液20.00mL,则产品中Cu2O的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知:①Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O; ②2SO2+SeO2+2H2O===Se+2 SO42-+4H+。
(1)Se与浓H2SO4的反应中,氧化剂是__________,还原剂是___________,反应中被还原的元素是________。当有标准状况下22.4 L SO2气体生成时,转移电子的物质的量是________ mol。
(2)依据反应①、②判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是______________________________________________________________________。
(3)用双线桥法标出反应②电子转移的方向和数目:_____________________________________。
(4)SeO2、KI和HNO3发生如下反应:SeO2+KI+HNO3→Se+I2+KNO3+H2O
配平上述反应的化学方程式。________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 可将氯气转化为液氯,储存于钢瓶中
B. 碳酸钡可用于医疗上作检查肠胃的内服药剂,即“钡餐”
C. 碘化银可用于人工降雨
D. 通常用热的纯碱溶液去除物品表面的油污
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用固体烧碱配制500mL 0.10 mol·L-1的NaOH 溶液,需要称取______g固体,称量NaOH固体时需要的仪器有_____________________,定容时所需的仪器有________________。
(2)实验室要用98%(ρ=1.84g·cm-3)的硫酸配制0.5mol·L-1的硫酸溶液250mL,需准确量取98%的硫酸_______mL,需要选择_______ml量筒。
(3)若配制0.5mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,下列所配制的硫酸溶液浓度偏低的是_________________________。
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒。
B.移液时容量瓶中有少量蒸馏水
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切。
D.用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的pH=12的碱溶液甲和pH=11的碱溶液乙,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙 , 下列判断合理的是( )
A.乙一定是弱碱
B.甲一定是强碱
C.乙一定是二元碱
D.甲一定是一元碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合径中乙炔的体积分数为( )
A.12.5%
B.25%
C.50%
D.75%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com